
【题目】写出下列各种化合物的结构简式:
(1)CH2=CH﹣CH3聚合得____,又已知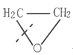 在虚线处开环聚合得
在虚线处开环聚合得![]() (此聚合物用作增稠剂和胶粘剂,)则开环
(此聚合物用作增稠剂和胶粘剂,)则开环 聚合得___(此聚合物用作合成纤维)。
聚合得___(此聚合物用作合成纤维)。
(2)已知涤纶树脂的结构简式如图所![]() ,请写出合成涤纶树脂所需要单体的结构简式:____和___。
,请写出合成涤纶树脂所需要单体的结构简式:____和___。
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)某温度时,测得0.01mol/L的NaOH溶液pH=13,该温度下水的Kw=__。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25.0kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-48.0kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__。
(3)已知25℃时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液pH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为__mol/L。
(4)生活中明矾常作净水剂,其净水的原理是__(用离子方程式表示)。
(5)常温下,取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,测得混合溶液后的pH=5,写出MOH的电离方程式:__。
(6)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:c(Na+)>c(HA-)>c(H2A)>c(A2-)
①该溶液中c(H+)__c(OH-)(填“>”、“<”或“=”)
②作出上述判断的依据是__(用文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M为一种医药的中间体,其合成路线为:
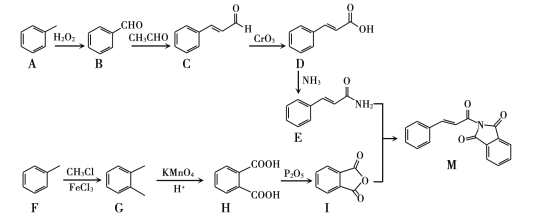
(1)A的名称____。
(2)C中含有的含氧官能团名称是____。
(3)F生成G的反应类型为____。
(4)写出符合下列条件的D的同分异构体的结构简式____
①能发生银镜反应 ②遇到FeCl3溶液显紫色 ③苯环上一氯代物只有两种
(5)H与乙二醇可生成聚酯,请写出其反应方程式____
(6)写出化合物I与尿素(H2N - CO - NH2)以2:1反应的化学方程式____
(7)参考题中信息,以1,3-丁二烯(CH2=CHCH= CH2)为原料,合成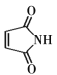 ,写出合成路线流程图(无机试剂任选)____。
,写出合成路线流程图(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对应的离子方程式正确的是( )
A.酸性高锰酸钾溶液和草酸溶液反应:![]()
B.向氯化铁溶液中通入过量二氧化硫:![]()
C.银和稀硝酸反应 ![]()
D.向氯水中加入碳酸钠:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )

A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol。试回答:
(1)烃A的分子式为______。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为______。
(3)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有______g烃A参加了反应,燃烧时消耗标准状况下的氧气______L。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式有(不考虑立体异构)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新化合物(如图所示),其中W、X、Y、Z 为同一短周期元素,Z 核外最外层电子数比X 核外电子数多1。下列叙述正确的是( )
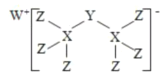
A.WZ 的熔点低于XZ4
B.元素非金属性的顺序为![]()
C.该新化合物中Y 不满足8 电子稳定结构
D.Y 的最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):
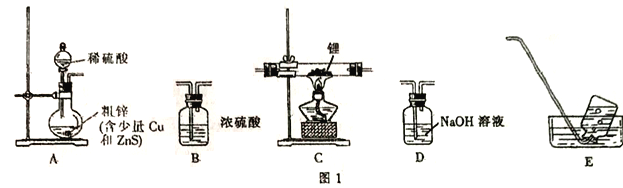
(1)装置的连接顺序(从左至右)为A→______________。
(2)检在好装蹬装置的气密性,点燃酒精灯前需进行的实验操作是_______________。
(3)写出制备氢化铝锂的化学方程式:__________________。
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。
(4)写出氢化锂与无水三氯化铝反应的化学方程式:____________________。
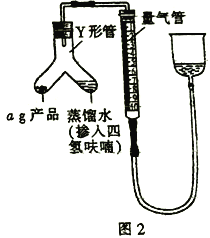
III.测定氢化铝锂产品(不含氢化锂)的纯度
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是________。读数之前上下移动量气管右侧的容器,使量气管左、右有两侧的液面在同一水平面上,其目的是_________。
(6)在标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al及其化合物在工业上有极其广泛的用途,
(1)焊接钢轨时用Al冶炼Fe的反应方程式为______;铝的化合物明矾可用于净水,其原理用离子方程式解释为___________。
(2)硅藻遗骸中主要成分是Al2O3、SiO2和Fe2O3。从中获取Al(OH)3的过程如下:
步骤I:取适量硅藻遗骸用70%H2SO4浸泡;
步骤II:向上述浸泡液中加入过量NaOH并过滤;
步骤III:向上述滤液中通入过量CO2过滤得到Al(OH)3。
①用70%H2SO4浸取硅藻遗骸的目的是________。
②步骤II中涉及铝元素的离子方程式为______;
③步骤III中能否用HCl代替CO2?_____(填“能”或“不能”);该步骤所得滤液中存在的电荷守恒式为_______;向该滤液中滴加少量NaOH溶液,则![]() ____填(“变大”、“变小”或“不变”)
____填(“变大”、“变小”或“不变”)
(3)Al(OH)3可用作阻热材料,试从Al(OH)3的化学性质角度分析其原因________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com