
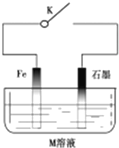
| A. | 常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀 | |
| B. | 关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑ | |
| D. | 关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法 |
分析 A.常温下,关闭K时,若M溶液为浓硫酸,金属铁被钝化;
B.关闭K时,若M为氯化钠,则发生金属铁的吸氧腐蚀;
C.关闭K时,若M为则硫酸铵,显示酸性,发生金属铁的析氢腐蚀;
D.关闭K时,若M溶液为海水,石墨换成铜或银,此时金属铁是负极,会加快金属的腐蚀速率.
解答 解:A.常温下,断开K时,若M溶液为浓硫酸,金属铁被钝化,铁受到保护,故A错误;
B.关闭K时,若M为氯化钠,则发生金属铁的吸氧腐蚀,金属铁是负极,铁电极的电极反应式为:Fe-2e-=Fe2+,故B错误;
C.关闭K时,若M为则硫酸铵,显示酸性,发生金属铁的析氢腐蚀,金属铁是负极,石墨极的电极反应式为:2H++2e-═H2↑,故C正确;
D.关闭K时,若M溶液为海水,石墨换成铜或银,此时金属铁是负极,会加快金属Fe的腐蚀速率,故D错误.
故选C.
点评 本题考查原电池原理,明确电极上发生的反应是解本题关键,注意金属的腐蚀和防护知识,难度中等.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 丙炔 | C. | 丁二烯 | D. | 甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
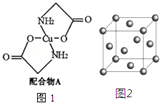 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
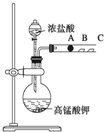 某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止Fe2+水解,Fe(NO3)2溶液需要加酸酸化 | |
| B. | 该反应中氧化剂与还原剂物质的量之比为8:1 | |
| C. | 若有1molNO3-发生氧化反应,则转移电子5mol | |
| D. | 该反应中Fe2+是还原剂,NH4+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 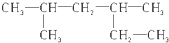 2,4-二甲基己烷 2,4-二甲基己烷 | |
| B. | 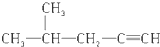 2-甲基-4-戊炔 2-甲基-4-戊炔 | |
| C. | 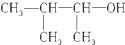 3-甲基-2-丁醇 3-甲基-2-丁醇 | |
| D. | CH3-CHBr-CHBr-CH3 2,3-二溴丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com