
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.1.8 g NH4+含有的电子数为NA
B.1 L 1 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
C.标况下,22.4 L NO与11.2 L O2充分反应后,生成物的分子总数为NA
D.50 mL 18 mol·L-1的浓硫酸与足量的铜片共热,生成SO2的分子数为0.45NA
【答案】A
【解析】
A. 一个NH4+含有10个电子,1.8 g NH4+物质的量为![]() ,因此1.8g NH4+含有的电子物质的量为1mol,数目为NA,故A正确;
,因此1.8g NH4+含有的电子物质的量为1mol,数目为NA,故A正确;
B. 1 L 1 mol·L1的NaAlO2水溶液中n(NaAlO2) = 1 L ×1 mol·L1=1mol,NaAlO2中含有的氧原子物质的量为2mol,溶液中水还含有氧原子,因此溶液中氧原子物质的量大于2mol,氧原子数目大于2 NA,故B错误;
C. 标况下,22.4 L NO即物质的量为![]() 与11.2 L O2即物质的量为
与11.2 L O2即物质的量为![]() ,发生2NO + O2 = 2NO2,即生成1molNO2,由于2NO2
,发生2NO + O2 = 2NO2,即生成1molNO2,由于2NO2![]() N2O4,因此生成物的分子总数小于NA,故C错误;
N2O4,因此生成物的分子总数小于NA,故C错误;
D. 50 mL 18 mol·L1的浓硫酸即物质的量n(H2SO4) = 0.05 L ×18 mol·L1=0.9 mol,与足量的铜片共热,根据Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O和浓硫酸反应过程中逐渐变稀,稀硫酸不与铜反应,因此生成SO2的分子数小于0.45 NA,故D错误。
CuSO4+ SO2↑+ 2H2O和浓硫酸反应过程中逐渐变稀,稀硫酸不与铜反应,因此生成SO2的分子数小于0.45 NA,故D错误。
答案为A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2018年11月《Nature Energy》报道了巾科院大连化学物理研究所科学家用Ni- BaH2 /Al2O3、Ni- LiH等作催化剂,实现了在常压、100-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 __ ;基态Ni2+的核外电子排布式为 ___,若该离子核外电子空间运动状态有15种,则该离子处于 ___(填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中NO3的空间构型为____。
②甘氨酸中N原子的杂化类型为____,分子中σ键与π键的个数比为____,晶体类型是 ___,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-2l℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是____。
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图l所示,导致这种变化的原因是____

(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为d pm,密度为ρg/cm3,则阿伏加德罗常数NA=____(列出表达式)mol-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
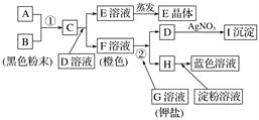
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜溶液可用于浸取硫铁矿中的铁,浸取时发生复杂的氧化还原反应,反应体系中除![]() 和
和![]() 外,还有
外,还有![]() 、
、![]() 、
、![]() 和
和![]() ,下列对该反应的分析不正确的是( )
,下列对该反应的分析不正确的是( )
A.氧化剂为![]() 和
和![]()
B.反应后溶液的pH降低
C.每转移2 mol电子消耗3 mol ![]()
D.被氧化的![]() 只占总量的30%
只占总量的30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象,推出的相应结论正确的是
实验 | 现象 | 结论 |
A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧 | 火焰呈黄色 | 此盐溶液中含有 Na+,不含 K+ |
B.向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C.将足量SO2气体通入石蕊试液中 | 石蕊试液变红色 | SO2水溶液显酸性 |
D.向酸性KMnO4溶液中通入SO2 | 溶液紫色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。

(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。

则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.标准状况下,1.12L氦气所含的原子数为0.1NA
C.1.8 g NH4+离子中含有的电子数为NA
D.15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
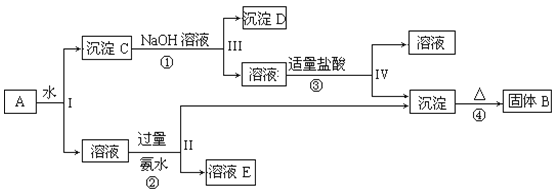
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是___。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式。
固体B___;C__;沉淀D___;
(3)写出①、②、③的离子方程式和④的化学方程式。
①___;
②___;
③___;
④____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com