
| A. | 氢氧化钙 | B. | 氢氧化铝 | C. | 氧化钙 | D. | 碳酸钡 |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:填空题
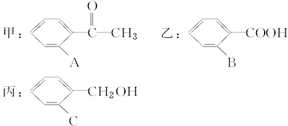 有甲、乙、丙三种有机物,其结构简式如下:
有甲、乙、丙三种有机物,其结构简式如下:| A | B | C |
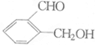 +2Na→2
+2Na→2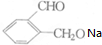 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙醇燃烧生成3 mol水 | |
| B. | 1 mol乙醇可以生成1 mol乙醛 | |
| C. | 1 mol乙醇跟足量的金属钠作用得0.5 mol氢气 | |
| D. | 乙醇的分子式为C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
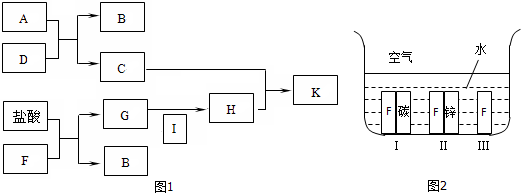
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com