
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。根据图示判断,下列结论中不正确的是

A. N点时溶液中的溶质只有NaCl
B. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
C. c(NaOH)=c(HCl)
D. 原混合溶液中c(MgCl2)∶c(AlCl3)=1∶1
【答案】B
【解析】
试题A、向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,首先发生反应:Mg2++2OH=Mg(OH)2↓,Al3++3OH=Al(OH)3↓,至N点时恰好完全反应,溶液中的溶质只有NaCl,故A正确;B、N点后继续加入NaOH溶液,Al(OH)3开始溶解,至M点Al(OH)3恰好完全溶解,M点至P点沉淀量不变,说明M点至P点先加NaOH溶液,然后加入稀盐酸,P点盐酸恰好中和NaOH,故B错误;C、点N至点M发生Al(OH)3溶解的反应:Al(OH)3+NaOH=NaAlO2+2H2O,点P至点F生成Al(OH)3:NaAlO2+HCl+H2O=Al(OH)3+NaCl,根据图像可知消耗的NaOH溶液与盐酸体积相同,则c(NaOH)=c(HCl),故C正确;D、点P至点F生成Al(OH)3:NaAlO2+HCl+H2O=Al(OH)3+NaCl,用去的盐酸为1mL,则ON段生成沉淀,生成Al(OH)3需要3mL NaOH溶液,生成Mg(OH)2需要NaOH溶液的体积为:5mL-3mL=2mL,则原混合溶液中c(MgCl2)∶c(AlCl3)=1∶1,故D正确。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,其中A是单质,它们之间存在如图转化关系
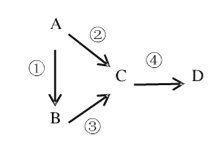
Ⅰ.若D是红棕色气体;B气体溶于水后,溶液为碱性。
(1)请写出A的化学式__________,反应③的化学反应方程式为_____________。
(2)D溶于水形成的稀溶液与铜反应的离子方程式为__________,该反应的实验现象为____________(写出两条)。
Ⅱ若B、D既能与强酸溶液反应,又能与强碱溶液反应,反应②③均为强酸条件。
(1)反应④可以通过滴加氨水实现,该反应的离子方程式为____________。
(2)请写出A用于焊接铁轨的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置分别盛放相应物质进行下列实验,得出结论正确的是

选项 | ① | ② | ③ | 判定结论 |
A | 浓硫酸 | 蔗糖 | 溴水 | 用来判定浓硫酸具有脱水性、氧化性 |
B | 稀盐酸 | Na2SO3 | Ba(NO3)2 | 用来判定SO2与可溶性钡盐均可生成白色沉淀 |
C | 浓盐酸 | Na2CO3 | Na2SiO3 | 用来判定酸性:盐酸>碳酸>硅酸 |
D | 浓硫酸 | Cu | NaOH | 用来判定制备SO2并吸收尾气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取的粗盐含有Ca2+、Mg2+、SO42-等离子,为除去杂质离子可使用以下四种试剂:①Na2CO3溶液②BaCl2溶液③NaOH溶液④盐酸(用于沉淀的试剂均稍过量)。
![]()
(1)请在操作流程中填入合适的试剂编号_______、_______、______。
(2)加入过量NaOH溶液的目的是除去_______(填离子符号)。
(3)写出加入盐酸后溶液中发生主要反应的离子方程式_________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法错误的是
A. 胶体粒子很小,能透过半透膜
B. 胶体与溶液的本质区别是分散质粒子直径大小的不同
C. 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘胶体中的胶粒带电。
D. 胶体能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的KW为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
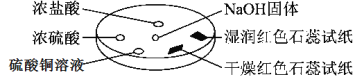
下表中对实验现象所做的解释不正确的是:
选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应产生了NH4Cl固体 |
B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
C | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3与水反应生成了NH3·H2O,电离出OH-使红色石蕊试纸变蓝 |
D | 硫酸铜溶液变浑浊 | 生成Cu(OH)2沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
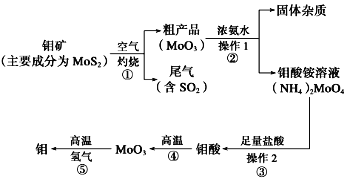
(1)写出在高温下发生反应①的化学方程式______________________________________________
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:________________________________
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_______________________
(4)某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
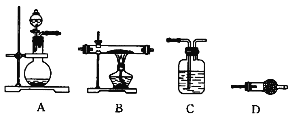
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是___________
② 在烧瓶A中加入少量硫酸铜的目的是____________________________
③ 两次使用D装置,其中所盛的药品依次是____________________、______________________
(5)工业上制备还原性气体CO和H2的反应原理为CO2 + CH4![]() 2CO + 2H2 CH4 + H2O
2CO + 2H2 CH4 + H2O![]() CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com