
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加人Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1molKOH的溶液与lmolCO2完全反应后,溶液中c(K+ )=c (HCO3- ) | |
| D. | 改变条件使醋酸溶液中的醋酸根离子浓度增大,溶液的pH值可能减小也可能增大 |
分析 A、强酸强碱不一定是一元强酸和一元强碱;
B、依据沉淀溶解平衡分析,在一定温度下溶度积为常数,硫酸根离子浓度增大,平衡逆向进行;
C、依据化学反应判断生成产物为碳酸氢钾,碳酸氢根离子水解;
D、醋酸根离子浓度增大,平衡右移,可以是减少氢离子浓度,可以是加入醋酸盐.
解答 解:A、强酸强碱不一定是一元强酸和一元强碱,等浓度等体积混合可能酸过量或碱过量,故A错误;
B、加入Na2SO4固体,硫酸根离子浓度增大,平衡逆向进行,钡离子浓度减小,故B错误;
C、含1mol KOH的溶液与1mol CO2完全反应后生成碳酸氢钾,碳酸氢根离子水解,c(K+)>c(HCO3-),故C错误;
D、要使得醋酸根离子浓度增大,可以是平衡右移,即氢离子浓度增大,pH减小,也可以是减少氢离子浓度,即加入醋酸钠,此时pH增大,故D正确;
故选D.
点评 本题考查了酸碱反应的溶液酸碱性判断,溶液中离子浓度大小比较,盐类水解的应用,溶液中电荷守恒的应用,沉淀溶解平衡的分析判断,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
 铜、锰及其合金是人类常用的金属材料.
铜、锰及其合金是人类常用的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | (NH4)2C2O4溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
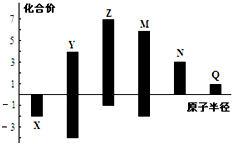 X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
| Ksp(单位略) | 1.1×10-11 | 2.3×10-3 | 1.8×10-10 | 1.9×10-12 |
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将O.001 mol•L-1的AgN03溶液滴入O.001 mol•L-1的KCl和O.001 mol•L-1 的K2CrO4混合溶液中.先产生Ag2Cr04沉淀 | |
| C. | 0.ll mol•L-1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com