
������14�֣�
�ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ��䷴Ӧԭ��Ϊ�� N2(g)+3H2(g)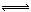 2NH3(g)+Q��Q��0��
2NH3(g)+Q��Q��0��
һ�ֹ�ҵ�ϳɰ��ļ�������ͼ���£�
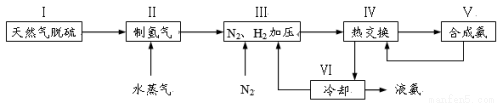
���������գ�
28����Ȼ���е�H2S���ʳ��ð�ˮ���գ�����ΪNH4HS��һ����������NH4HS��Һ��ͨ��������õ�������ʹ����Һ������NH4HS�ĵ���ʽ��_______________��д��������Ӧ�Ļ�ѧ����ʽ��_______________��NH3�ķе����H2S������ΪNH3����֮�������һ�ֱ�_________����ǿ����������
29�������£�0.1 mol/L���Ȼ����Һ��0.1 mol/L�����������Һ�����Ը�ǿ����_______����ԭ����_______��
��֪��H2SO4��Ki2=1.2��10��2 NH3��H2O��Ki=1.8��10��5
30��ͼ�ױ�ʾ500�桢60.0MPa�����£�ԭ����Ͷ�ϱ���ƽ��ʱNH3��������Ĺ�ϵ������ͼ��a�����ݼ���N2��ƽ�����������______������С����ʾ������3λ��Ч���֣���
31�������¶ȶԺϳɰ���Ӧ��Ӱ�죬��ͼ������ϵ�У�����һ�������µ��ܱ������ڣ���ͨ��ԭ������ʼ�����¶Ȳ������ߣ�NH3���ʵ����仯������ʾ��ͼ��


32����������ͼ�У�ʹ�ϳɰ��ų��������õ�������õ���Ҫ�����ǣ�����ţ�________��
��������������ߺϳɰ�ԭ����ת���ʵķ�����________________________________��
����14�֣�28��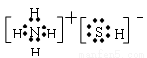 ��2�֣�2NH4HS+O2=2S��+2NH3��H2O��2�֣�
��2�֣�2NH4HS+O2=2S��+2NH3��H2O��2�֣�
���»�
29��NH4HSO4 ��HSO4���нϴ�̶ȵĵ��룬ʹ��Һ�ʽ�ǿ���ԡ���NH4Clֻ��NH4+ˮ��������ԡ���2�֣�
30����0.143 �� 0.145֮�����ȷ��2�֣���
31�� ��2�֣�
��2�֣�
32���� ��ԭ������ѹ�������Һ����δ��Ӧ��N2��H2ѭ�����ã�
��������
���������28�� NH4HS�����ӻ���������ʽ��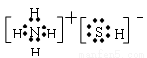 ����������������Ӧ�Ļ�ѧ����ʽ��2NH4HS+O2=2S��+2NH3��H2O��NH3�ķе����H2S������Ϊ���������ʶ��Ƿ��Ӿ��壬��NH3����֮�������һ�ֱȷ��»�����ǿ�����������������
����������������Ӧ�Ļ�ѧ����ʽ��2NH4HS+O2=2S��+2NH3��H2O��NH3�ķе����H2S������Ϊ���������ʶ��Ƿ��Ӿ��壬��NH3����֮�������һ�ֱȷ��»�����ǿ�����������������
29�������������£�H2SO4��Ki2=1.2��10��2��NH3��H2O��Ki=1.8��10��5 ��˵��HSO4-�ĵ�������Զ����NH4+��ˮ�����ã�HSO4-������c(H+)����笠�����ˮ�����ò�����c(H+)������0.1 mol/L���Ȼ����Һ��0.1 mol/L�����������Һ�����Ը�ǿ����NH4HSO4��
30������ͼ�����ݿ�֪: a��ʱ��n(H2)��n(N2)=3:1,���翪ʼʱn(N2)=1mol����n(H2)=3mol�����ݷ���ʽ��N2(g)+3H2(g) 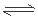 2NH3(g)���ڷ�Ӧ����������N2�����ʵ�����x��ƽ��ʱ������������ʵ�����n(N2)=(1-x)mol��n(H2)=(3-3x)mol,n(NH3)=2xmol��������ƽ��ʱNH3��ƽ��ʱ�����������42%,����2x��[(1-x)+ (3-3x)+2x]= 42%. ���x=0. 5915mol�����Լ���N2��ƽ���������(1-x) ��[(1-x)+ (3-3x)+2x]= 0.145��
2NH3(g)���ڷ�Ӧ����������N2�����ʵ�����x��ƽ��ʱ������������ʵ�����n(N2)=(1-x)mol��n(H2)=(3-3x)mol,n(NH3)=2xmol��������ƽ��ʱNH3��ƽ��ʱ�����������42%,����2x��[(1-x)+ (3-3x)+2x]= 42%. ���x=0. 5915mol�����Լ���N2��ƽ���������(1-x) ��[(1-x)+ (3-3x)+2x]= 0.145��
31���ϳɰ��ķ�Ӧ�Ƿ��ȷ�Ӧ���ڷ�Ӧ��ʼ�����ŷ�Ӧ�Ľ��У��¶�������û��Ӧ�����ӿ죬����Ӧ�ﵽƽ��ʱ���ʴﵽ���ֵ����ȫ�ĺ���Ҳ�ﵽ���ֵ���˺����ŷ�Ӧ�Ľ��У����������¶ȣ�ƽ�������ȷ�Ӧ���淴Ӧ�����ƶ���������ƽ�⺬������С������һ�������µ��ܱ������ڣ���ͨ��ԭ������ʼ�����¶Ȳ������ߣ�NH3���ʵ����仯������ʾ��ͼ��
 ��
��
32������ͼʾ��֪��������ͼ�У�ʹ�ϳɰ��ų��������õ�������õ���Ҫ�����Ǣ����ڱ���������ߺϳɰ�ԭ����ת���ʵķ����Ƕ�ԭ������ѹ������Һ����δ��Ӧ��N2��H2ѭ�����á�
���㣺�������ʵ���ʽ����ѧ����ʽ����д������ʵĵ��뼰�ε�ˮ�⡢���ʵ������������༰ǿ���Ƚϡ�����ƽ�⺬���ļ��㡢���ʶԿ��淴Ӧ��Ӱ�졢���ʺ�������ѭ�����õ�֪ʶ��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ��һ��ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ�У���100 mL 0.5 mol/L NaCl��Һ������Cl�� ���ʵ���Ũ����ͬ����
A��100 mL 0.5 mol/L MgCl2��Һ B��200 mL 0.25 mol/L AlCl3��Һ
C��50 ml 1 mol/L NaCl��Һ D��50 ml 0.5 mol/L HCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㽭ʡ�����и߶���ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ҵ�ϳɰ���ӦΪ3H2(g) + N2(g) ? 2NH3(g) ��H��0�����д�ʩ��ʹ��Ӧ���л���Ӱٷ�������ķ�����
������N2��Ũ�ȣ��������¶ȣ�������ѹǿ������ȥNH3���ݼ��������
A���٢ڢ� B���٢ڢۢ� C���٢ڢۢܢ� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ��ɽ�и�����һ�ε����о��������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Al��CuO��Fe2O3��ɵĻ���ﹲ10.0 g������500 mLijŨ�ȵ�������Һ�У��������ȫ�ܽ⣬���ټ���250 mL 2.0 mol/L��NaOH��Һʱ���õ��ij�����ࡣ����������Һ��Ũ��Ϊ
A��0.5 mol/L B��1.0 mol/L
C��2.0 mol/L D��3.0 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ�����У������ѧ�����Ͻ�ѧ�������л�ѧ�Ծ��������棩 ���ͣ�������
�����14�֣�
����[ CaSx(x��5)]������������ɵĻ�����Ϊʯ��ϼ�������һ�ֺܺõ�ֲ��ɱ�����������Ǹ�ʯ�ҡ�ˮ�ȷ�Ӧ���á���ͬ��������Ǹ�ʯ����ˮ��Һ�з�Ӧ�������ɲ�ͬ�Ķ������������ơ�
3Ca(OH)2+8S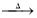 2CaS3+CaS2O3+3H2O��3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O��3Ca(OH)2+6S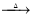 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O
������м��㣺
52������ܽ���������Һ������һ�ֶ�����ö���������Ԫ�ص���������Ϊ0.736�����Na2Sx��x = ��
53��ȡijʯ��ϼ�������ֻ�����ֺ����250mL���ܶ�Ϊ1.12g/cm3��ͨ������CO2ʹ����ٷֽ⡣ԭ�����£� Sx2��+2H2O+2CO2��(x��1)S��+H2S��+2HCO3����S2O32��+ H2O+CO2��HSO3��+HCO3��+S����ȫ��Ӧ���ռ�������1.12������״������������������Һ�е��ܽ⣩�����ʯ��ϼ��ж��Ƶ����ʵ���Ũ��Ϊ ���������Ƶ���������Ϊ ��������С����ʾ������2λ��Ч���֣�
54���������ʯ�ҡ���Ǻ�ˮ��������7��16��70�������ȫ��Ӧ��ֻ�������ֺ���Ļ�������ʯ��ϼ��ж������������Ƶ����ʵ���֮���� �����ƵĻ�ѧʽ�� ��
55��������ʯ��50.4g�����96g��ˮ504gǡ����ȫ��Ӧ�������ֶ��ƣ�������CaS4֮��ж��ֶ��ơ�����������ֶ��ƿ��ܵ����ʵ���֮�ȣ�д���������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ�����У������ѧ�����Ͻ�ѧ�������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A��1 mol�ױ�����C��H����ĿΪ8NA
B��1 mol��ϩ���к���˫������ĿΪNA
C����a g C2H4��C3H6��ɵĻ�������������õ��Ӷ���ĿΪ3aNA/14
D���ڹ������Ƹ�ˮ�ķ�Ӧ�У�ÿ����2.24 L������ת�Ƶ��ӵ���ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ�����У������ѧ�����Ͻ�ѧ�������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼװ��(�г֡�����װ������)����ʵ�飬�ɢ���������֤ʵ���з�Ӧ��������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�����и�����ѧ�ڽ��Ŀ��Ի�ѧ�Ծ��������棩 ���ͣ������
��8�֣����У�������ͭ ��̼��ƹ��� ������ ������ ���������� ����þ ��ʯī ����Լ� ��NH3��H2O ��ʯ��ˮ����������ǿ����ʵ��� ������������ʵ��� �����ڷǵ���ʵ��� ���Ȳ��ǵ���ʣ��ֲ��Ƿǵ���ʵ��� ��������ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ��һ12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��Fe��Al2O3��SiO2��NaClO��NaAlO2�ķ�����ȷ����
A������Ӧ��������Al2O3��SiO2 B���������ᷴӦ��������Fe��Al2O3��SiO2
C������ˮ��Ӧ��������Fe��Al2O3 D���������Ե�������Al2O3��SiO2��NaAlO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com