
| N2+3H2?2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
分析 (1)N2+3H2?2NH3该反应是放热的可逆反应,要使平衡向正反应方向移动,应降低温度,但温度过低反应速率过小,不利于工业生成效益;温度越高,反应速率越大,所以应适当升高温度,使反应速率增大;使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度;
(2)密闭容器中,气体物质的量之比等于压强之比,压强为反应前的0.8倍,反应后的物质的量为反应前的0.8倍,利用差量法计算出生成氨气的物质的量,再根据反应速率表达式计算出0到2分钟氨气的平均反应速率;
(3)根据可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(4)能加快该反应的反应速率,可以增大了压强、增大反应物浓度、升高温度;增大反应物转化率,说明平衡向着正向移动,据此进行分析;
(5)氨水中存在电离平衡,根据影响电离平衡的因素进行判断;
(6)氨水与盐酸等浓度等体积混合,反应后生成了氯化铵溶液,根据影响铵离子水解的因素进行分析.
解答 解:(1)升高温度可增大反应速率,提高产量,工业上合成氨的温度一般控制在500℃,原因主要是从反应的速率角度来考虑的,因为催化剂的活性温度且反应速率较快,该温度时,催化剂的活性最大,有利于增大反应速率,提高产量,
故答案为:催化剂的活性温度且反应速率较快;
(2)若2分钟后,容器内压强为原来的0.8倍,说明反应后气体的物质的量减少了0.2×(1mol+3mol)=0.8mol,
则 N2+3H2?2NH3 减少 的△n
1 3 2 2
n 0.8mol
解得:n=0.8mol,
0到2分钟氨气的平均反应速率为:v(NH3)=$\frac{0.8mol}{\frac{2L}{2min}}$=0.2 mol/(L•min),
故答案为:0.2;
(3)A.该反应是体积缩小的反应,气体的物质的量逐渐减小,而气体的质量不变,所以气体的平均摩尔质量为变化的量,若气体的平均分子量不再变化,说明正逆反应速率相等,达到了平衡状态,故A正确;
B. 该反应是体积缩小的反应,气体的物质的量逐渐减小,容器内的压强是个变化的量,若密闭容器内的压强不再变化,说明正逆反应速率相等,达到了平衡状态,故B正确;
C.v(N2)=2v(NH3),没有告诉是正反应速率还是逆反应速率,且不满足二者的化学计量数关系,说明没有达到平衡状态,故C错误;
D.该反应两边都是气体,气体的质量始终不变,容器的容积不变,所以气体的密度始终不变,所以密度不能作为判断平衡状态的依据,故D错误;
故选AB;
(4)A.使用催化剂,加快了反应速率,但是不影响化学平衡,反应物的转化率不变,故A错误;
B.缩小容器体积,增大了压强,增大了反应速率,平衡向着正向移动,反应物转化率增大,故B正确;
C.提高反应温度,增大了反应速率,但是平衡向着逆向移动,反应物转化率减小,故C错误;
D.移走氨气,反应物减小,正逆反应都将速率都减小,故D错误;
故选B;
(5)A.氨水中加入氯化铵,溶液中铵离子浓度增大,抑制了一水合氨的电离,溶液中氢氧根离子浓度减小,溶液的pH减小,故A错误;
B.氨水中铵离子浓度增大,一水合氨的电离平衡向着逆向移动,所以氨水的电离度减小,故B正确;
C.氨水中的铵离子浓度增大,溶液中氢氧根离子浓度减小,c(OH-)减小,故C正确;
D.加入了氯化铵,溶液中铵离子浓度增大,故D错误;
故选AD;
(6)将氨水与盐酸等浓度等体积混合,反应后的溶液为氯化铵溶液,
A.加入固体氯化铵,溶液中铵离子浓度增大,铵离子水解程度减小,则铵根离子浓度增大,且铵根离子增大的程度比氯离子增大的程度多,铵根离子与氯离子的比值变大,故A正确;
B.通入少量氯化氢,尽管抑制了铵离子的水解,但是溶液中增加的氯离子的物质的量大于增加的铵离子的物质的量,铵离子与氯离子的浓度之比变小,故B错误;
C.降低溶液温度,铵离子的水解程度减小,铵离子与氯离子的浓度之比增大,故C正确;
D.加入少量固体氢氧化钠,溶液中铵离子的物质的量减小,铵离子与氯离子的物质的量之比减小,故D错误;
故选AC.
点评 本题考查了化学平衡状态的判断、化学平衡的影响因素的分析、盐的水解应用等知识,题目难度中等,试题涉及的内容较多,题量较大,充分考查了学生对所学知识的掌握情况.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
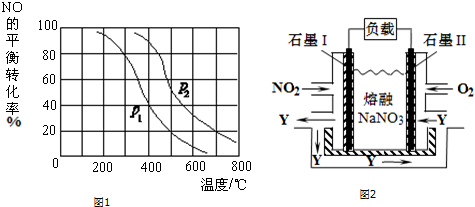
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
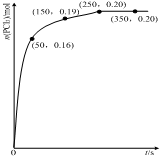 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 该反应的平衡常数K=0.025 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20molPCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol•L-1,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
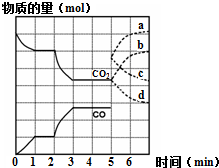 有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.
有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
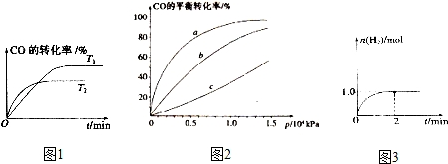
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
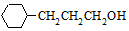 流程图如图
流程图如图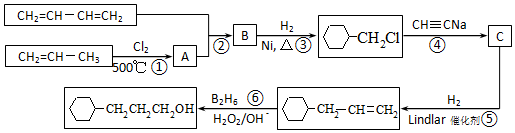
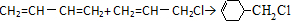 .
.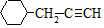 .
.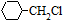 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式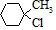 .
.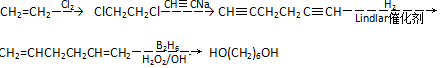 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com