
【题目】如图为室温下某二元酸H2M溶液中H2M、HM-、M2-的浓度对数lgc随pH的变化图象。下列分析错误的是

A.该二元酸溶液浓度为0.010 mol/L
B.pH=1.89时,c(H2M)=c(HM-)>c(M2-)
C.pH=7.0时,lgc(M2-)-lgc(HM-)=0.77
D.在NaHM溶液中,水的电离受到抑制
【答案】A
【解析】
据图可知溶液中H2M、HM-、M2-三种微粒可以同时存在,所以H2M应为二元弱酸, pH增大的过程中发生反应:H2M+OH-=HM-+H2O、HM-+OH-=M2-+H2O;
A.起点处,溶液中主要存在H2M![]() HM-+H+,据图可知c(H2M)=0.1mol/L,c(HM-)=0.001mol/L,根据物料守恒,二元酸的浓度应为0.1mol/L+0.001mol/L=0.101mol/L,故A错误;
HM-+H+,据图可知c(H2M)=0.1mol/L,c(HM-)=0.001mol/L,根据物料守恒,二元酸的浓度应为0.1mol/L+0.001mol/L=0.101mol/L,故A错误;
B.据图可知pH=1.89时c(H2M)=c(HM-)>c(M2-),故B正确;
C.lgc(M2-)-lgc(HM-)=lg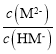 ,Ka2=
,Ka2=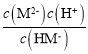 ,据图可知pH=6.23时,
,据图可知pH=6.23时,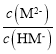 =1,所以Ka2=10-6.23,温度不变平衡常数不变,所以pH=7.0时
=1,所以Ka2=10-6.23,温度不变平衡常数不变,所以pH=7.0时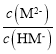 =
=![]() ,所以lg
,所以lg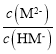 =0.77,故C正确;
=0.77,故C正确;
D.在NaHM溶液中含M元素主要以HM-的形式存在,据图可知当溶液中c(HM-)最大时,溶液呈酸性,说明HM-的电离程度大于水解程度,而电离抑制水的电离,水解促进水的电离,所以水的电离受到的抑制作用更大,故D正确;
故答案为A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:

已知:
①I2(s)+I-(aq)![]() I3-(aq)。
I3-(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO3-离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为___。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是___。
(2)步骤Ⅱ,水合肼与IO反应的离子方程式为___。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。上述①②③操作中,调整pH值时依次加入的试剂为___。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有___。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为___。
(5)将制备的NaI2H2O粗品以无水乙醇为溶剂进行重结晶。请给出合理的操作排序___。
加热乙醇→ → → → →纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③NaI2H2O粗品溶解 ④趁热过滤 ⑤真空干燥 ⑥抽滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,测得混合溶液的导电能力随时间变化 的曲线如右图所示,下列说法正确的是
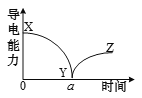
A.XY段溶液的导电能力不断减弱,说明H2SO4不是电解质
B.a时刻表明参加反应的两种溶液的体积相等
C.Y处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
D.YZ段溶液的导电能力不断增大,主要是由于Ba(OH)2电离出的离子导电
查看答案和解析>>
科目:高中化学 来源: 题型:
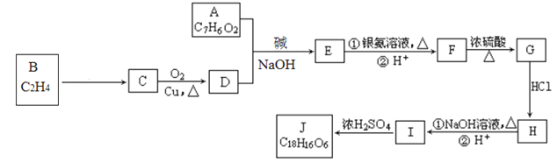
【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。合成路线如图:
已知:R1—CHO+ R2—CH2—CHO![]()
![]() 。
。
请回答:
(1)已知:A能发生银镜反应,与![]() 溶液发生显色反应,核磁共振氢谱显示有4组峰,峰面积之比为1:2:2:1,则A的结构简式是__。
溶液发生显色反应,核磁共振氢谱显示有4组峰,峰面积之比为1:2:2:1,则A的结构简式是__。
(2)J的结构简式是__,G所含官能团的名称是__。
(3)写出A与D反应生成E的化学方程式__,H→I的反应类型是__。
(4)符合下列条件E的酸化产物的同分异构体有__种。
①苯环上有2个取代基②能遇FeCl3溶液发生显色反应③能发生水解反应
(5)结合题中给信息,设计以C2H4为原料反应制备1,3-丁二烯的合成路线___(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3![]() TiCl4↑+TiCl2回答下列问题。
TiCl4↑+TiCl2回答下列问题。
(1)某同学所画基态 Cl-的外围电子排布图为![]() ,这违反了____________
,这违反了____________
(2)从结构角度解释 TiCl3中Ti(III)还原性较强的原因____________。
(3)钛的氯化物的部分物理性质如下表:
氯化物 | 熔点/℃ | 沸点/℃ | 溶解性 |
TiCl4 | -24 | 136 | 可溶于非极性的甲苯和氯代烃 |
TiCl2 | 1035 | 1500 | 不溶于氯仿、乙醚 |
①TiCl4与TiCl2的晶体类型分别是____________。
②TiCl4与SO42-互为等电子体,因为它们____________相同;SO42-中心原子以3s轨道和3p轨道杂化。
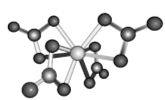
(4)Ti的配合物有多种。Ti(CO)6、Ti(H2O)63+、TiF62-的配体所含原子中电负性最小的是__________;Ti(NO3)4的球棍结构如图,Ti的配位数是_____________
(5)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图:
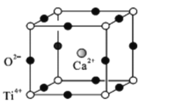
①设N为阿伏加德罗常数的值,计算一个晶胞的质量为______________g.
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则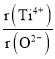 =_________。
=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3的物质的量为____mol(已知:KClO3被还原成KCl)。
(2)向200mL0.1mo/L 的Fe(NO3)2溶液中加入适量的NaOH 溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧后得到固体的质量为___g。
(3)将0.51g的Mg、Al混合物溶于500mL,4mol/L HCl,加入2mol/L NaOH,要使沉淀的量达到最大值,则加入NaOH的量最少为___mL。
(4)200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增大了7.2g,则原混合气体的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组加入相应试剂后,发生反应的离子方程式正确的是( )
离子组 | 加入试剂 | 离子方程式 | |
A | Na+、 | Ba(OH)2溶液 | 2Na++ |
B | H+、Cl- | 足量石灰乳 | 2H++2OH-=2H2O |
C | K+、 | NaHSO4溶液 |
|
D | Ag+、 | 少量盐酸 | Ag++ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,CO2的捕捉、排集、利用成为科学家研究的重要课题。太空舱产生的 CO2用下列反应捕捉,以实现 O2的循环利用。
Sabatier 反应:CO2(g)+4H2(g)CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)将原料气按 n(CO2)∶ n(H2)=1∶4 置于密闭容器中发生 Sabatier 反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
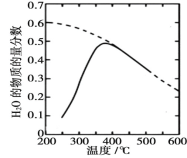
①该反应的平衡常数 K 随温度升高而________(填“增大”或“减小”)。
②温度过高或过低均不利于该反应的进行,原因是________。
③下列措施能提高 CO2 转化效率的是________(填标号)。
A. 适当减压
B. 增大催化剂的比表面积
C. 反应器前段加热,后段冷却
D. 提高原料气中 CO2 所占比例
E. 合理控制反应器中气体的流速
(2)将一定量的 CO2(g)和 CH4(g)通入一恒容密闭容器中发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g) Δ H =+248 kJ·mol-1。
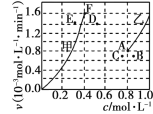
为了探究该反应的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2 与CH4 ,使其物质的量浓度均为1.0mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图, v正~ c(CH4)和 v逆 ~ c(CO)。则与 v正~ c (CH4)相对应曲线是图中________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
(3)用稀氨水喷雾捕集 CO2最终可得产品NH4HCO3。在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s) 2NH3(g)+CO2 (g)。实验测得的有关数据见下表( t1 < t2 < t3 )
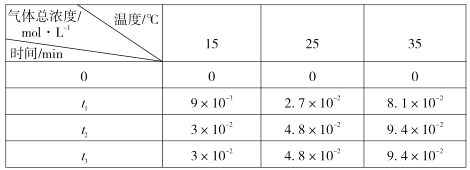
氨基甲酸铵分解反应是________(填“放热”或“吸热”)反应。15℃时此反应的化学平衡常数 K =________。
(4)一种新的循环利用方案是用 Bosch 反应 CO2(g)+2H2(g) C(s)+2H2O(g)代替 Sabatier 反应。
① 已知 CO2(g)、H2O(g)的生成焓分别为–394 kJmol-1 、–242 kJmol-1 ,Bosch 反应的Δ H =________kJmol-1(生成焓指一定条件下由对应单质生成 1mol 化合物时的反应热)。
②一定条件下 Bosch 反应必须在高温下才能启动,原因是________。
③该新方案的优点是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com