
在0.5 L的密闭容器中,一定量的氮气与氢气进行如下反应:N2(g)+3H2(g)
2NH3(g) ΔH=a kJ·mol-1,其化学平衡常数K与温度的关系如下。
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
请回答下列问题。
(1)写出该反应的化学平衡常数表达式:_______________________________,a________(填“大于”、“小于”或“等于”)0。
(2)400 ℃时,2NH3(g)  N2(g)+3H2(g)的化学平衡常数为__________,测得氨气、氮气、氢气的物质的量分别为3 mol、2 mol、1 mol时,该反应的v正(N2)________(填“大于”、“小于”或“等于”)v逆(N2)。
N2(g)+3H2(g)的化学平衡常数为__________,测得氨气、氮气、氢气的物质的量分别为3 mol、2 mol、1 mol时,该反应的v正(N2)________(填“大于”、“小于”或“等于”)v逆(N2)。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列制取蒸馏水的实验装置与操作的说法中,不正确的是( )
A.蒸馏一定需要温度计
B.冷凝管中的水流方向是从下口进入,上口排出
C.实验中需要在蒸馏瓶中加入几粒碎瓷片,防止出现暴沸现象
D.蒸馏烧瓶必须垫石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2+SO2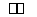 NO+SO3,平衡时,下列叙述正确的是( )
NO+SO3,平衡时,下列叙述正确的是( )
①NO和SO3的物质的量一定相等 ②NO2和SO2的物质的量一定相等 ③体系中的总物质的量一定等于反应开始时总物质的量 ④SO2、NO2、NO、SO3的物质的量一定相等
A.①和 ② B.②和③
② B.②和③
C.①和③ D.③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积恒定的密闭容器中,一定量的SO2与1.100 mol O2在催化剂作用下加热到600 ℃
发生反应:2SO2+O2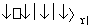 2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是 ( )
2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是 ( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g
D.达到平衡时,S O2的转化率为90%
O2的转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:H2(g)+I2(g)  2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示,符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示,符合图示的正确判断是
A.T1>T2,ΔH>0 B.T1>T2,ΔH<0
C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中进行如下反应:
N2+3H2 2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
A.平衡不发生移动 B.平衡沿着逆反应方向移动
C.正逆反应速率都增大 D.NH3的质量分数增加

查看答案和解析>>
科目:高中化学 来源: 题型:
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:① H2(g)+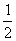 O2(g)=H2O(g)
O2(g)=H2O(g) △H=-241.8kJ·mol-1
△H=-241.8kJ·mol-1
② C(s)+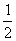 O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
(2)已知汽车汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H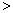 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
①在1300oC 时,该反应的平衡常数表达式K= 。5s内该反应的平均速率ν(N2) = (保留2 位有效数字);
位有效数字);
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
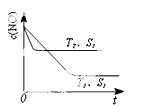
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g)+2CO(g) 
 2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对可逆反应2X(g) + Y(g) 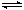 3Z(g) + W(s) ΔH>0
3Z(g) + W(s) ΔH>0
的叙述正确的是
A.加入少量W,逆反应速率增大,平衡向左移动
B.增大压强,正反应速率增大,逆反应速率减小
C.温度、体积不变,充入He气增大压强,反应速率会加快
D.升高温度,混合气体的平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是________。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他 们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验。
们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验。
| 实验 | 酸或碱[ | 现象 |
| A | 1滴0.2 mol/L NaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1 mol/L硫酸 | 迅速变棕褐色 |
该小组从上述对比实验中,可以得出的结论是____________________________
__________________________________________________。
写出在酸性条件下,MnO2氧化I-的离子方程式_____________________________
__________________________________________________。
(3)为了探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1 g/cm3)配制浓度约为3%的H2O2溶液(密度近似为1 g/cm3)100 mL。其配制方法是:用量筒量取________mL 30% H2O2溶液放入________(填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2===2KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确________。
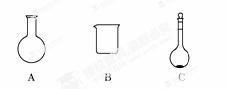
(5)实验室用二氧化锰和浓盐酸共热制取氯气,下列仪器可作为该反应的反应容器的是________(填序号)。
(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH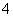 ===Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为________________________________________。
===Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com