
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)Mn3+基态核外电子排布式为____。
(2)NO![]() 的空间构型为___;CH3COOH分子中碳原子的轨道杂化类型为__。
的空间构型为___;CH3COOH分子中碳原子的轨道杂化类型为__。
(3)配合物[Mn(CH3OH)6]2+中配位原子是__。
(4)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还因为___。
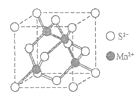
(5)MnS晶体具有α、β、γ三种形态,其中β-MnS的晶胞结构如图所示,则Mn2+的配位数为____。
【答案】[Ar]3d4或ls22s22p63s23p63d4 平面三角形 sp2,sp3 O CH3COOH分子与H2O分子间可形成氢键 4
【解析】
根据原子的电子排布式确定其离子的电子排布情况;根据等电子原理确定空间构型;有机物中的碳原子的杂化方式可以根据其成键情况进行判断;根据原子是否有孤电子对分析配位原子;根据氢键对物质的溶解性的影响分析物质的溶解性;根据晶胞结构确定原子的配位数。
(1)Mn的原子序数是25,其基态原子的电子排布式为ls22s22p63s23p63d54s2,则Mn3+基态核外电子排布式为[Ar]3d4或ls22s22p63s23p63d4。
(2)等电子体的空间构型相似,NO![]() 与BF3是等电子体,因为BF3的空间构型为平面三角形,故NO
与BF3是等电子体,因为BF3的空间构型为平面三角形,故NO![]() 的空间构型为平面三角形;CH3COOH分子中甲基上的碳原子形成4个σ键,故其为sp3杂化,羧基中的碳原子形成3个σ键和1个π键,故其轨道杂化类型为sp2。
的空间构型为平面三角形;CH3COOH分子中甲基上的碳原子形成4个σ键,故其为sp3杂化,羧基中的碳原子形成3个σ键和1个π键,故其轨道杂化类型为sp2。
(3)配合物[Mn(CH3OH)6]2+中配体是甲醇,只有氧原子含有孤对电子,配位原子是O。
(4)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还因为CH3COOH分子与H2O分子间可形成氢键。
(5)根据β-MnS的晶胞结构图Mn2+位于S2-形成的正四面体中,则Mn2+的配位数为4。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】第 VIII 族元素,跟主族元素的金属相比,它们有熔、沸点高、硬度高、密度大等特点,并有良好的延展性和高导电、导热性。下列有关它们及其化合物的结构与性质,请填写:
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为________,提供孤对电子的成键原子是________。
(2)①Co元素形成CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)各1mol,分别与足量硝酸银溶液反应,都得到1molAgCl沉淀。两种配合物中配合离子的配位数都是________,CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)的组成相同而颜色不同的原因是________。
②Co(OH)2为两性氢氧化物,在浓的强碱溶液中可以形成[Co(OH)4]2。写出Co(OH)2酸式电离的电离方程式__________。
(3)与 Co 属于同周期同族的过渡元素A,其基态原子排布中有四个未成对电子。
①由此元素可构成固体X,区别X为晶体或非晶体的方法为______________。
②A可与CO反应生成A(CO) 5 ,常压下熔点为-20.3℃,沸点为103.6℃,该晶体类型是______________。
③A3+与SCN不仅能以1:3的个数比配合,还可以其它个数比配合。若 A3+与SCN以1:4 的个数比配合,则ACl3与KSCN在水溶液中发生反应的化学方程式可表示为_______。
④A 可与另两种元素B、C构成某种化合物,B、C的外围电子排布分别为3d104s1、3s23p4,其晶胞如图所示,则其化学式为_________。
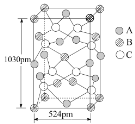
该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d=__________g﹒cm3。(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统中草药金银花对治疗“新冠肺炎”有效,其有效成分“绿原酸”可由“奎尼酸”在一定条件下人工合成:
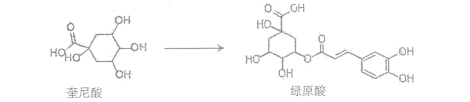
下列说法正确的是( )
A.绿原酸分子中所有碳原子在同一平面内
B.奎尼酸与绿原酸都能与FeCl3溶液发生显色反应
C.绿原酸与足量氢气完全加成,每个产物分子中含有6个手性碳原子
D.等物质的量的奎尼酸与绿原酸分别与足量NaOH溶液反应,最多消耗NaOH的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为石蜡油分解的实验装置。在试管①中加入石蜡油和氧化铝;试管②放在冷水中;试管③中加入酸性高锰酸钾溶液;试管④中加入溴水。分析实验完成下列各题:
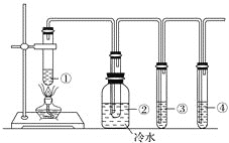
分析实验回答下列问题:
(1)试管①中加入氧化铝的作用是____________________________________________。
(2)试管②内看到的实验现象是______________________________________________。
(3)试管③中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(4)试管④中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(5)通过本实验说明______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制糖工业中利用蔗糖和氯酸钠制备二氧化氯,用于蔗糖的杀菌消毒及蔗渣造纸的漂白,工艺流程如图:
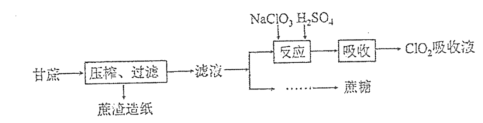
己知:①ClO2易溶于水,稀溶液于冷暗处相对稳定,沸点为11℃,遇光、热易引走垦爆炸,常用空气、二氧化碳等气体稀释降低爆炸性。
②NaClO2易溶于水,难溶于乙醇,水溶液常温下稳定,酸性条件下易产生ClO2,高于60℃时易分解。
(1)“反应”阶段控制温度80~90℃,反应的化学方程式为___。该工艺流程中用蔗糖做还原剂可能的优点是___。
(2) “吸收”阶段用真空泵将气体引入蒸馏水中制得ClO2吸收液。实验室模拟该流程,需控制吸收液的温度以提高吸收率,控温最适宜的操作是___。为提高实验安全性,可用足量的NaOH和H2O2混合液吸收反应后的气体以获得更稳定的NaClO2,实验装置如图(部分装置已略去)。图中装置B的作用是___。混合液吸收ClO2的离子方程式为___。

(3)装置c中获得的NaClO2中混有少量Na2CO3等杂质,为获得较纯净的NaClO2,可用足量的Ba(OH)2和H2O2混合液吸收反应后的气体,再进一步除杂。NaClO2的溶解度如图所示,请补充完整由吸收液制备少量无水亚氯酸钠的实验方案:将反应产生的气体通入足量Ba(OH)2和H2O2混合液中充分吸收,过滤,向滤液中___。

(实验中须使用的试剂和仪器有:饱和Na2SO4溶液,乙醇,减压装置)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是

A.二者物质的量之比为3:2
B.二者质量之比为2:3
C.二者分别与足量的氢氧化钠溶液,产生气体体积仍然相等
D.二者消耗H2SO4的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸铜[(CH3COO)2Cu·H2O](其相对式量为200)常用作分析化学的分析试剂,还用作有机合成催化剂、瓷釉颜料等。可以用碱式碳酸铜与醋酸作用来制备。
实验步骤:
(I)碱式碳酸铜的制备
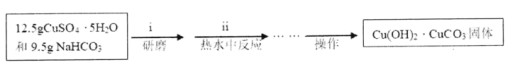
(Ⅱ)醋酸铜的制备
碱式碳酸铜与醋酸反应制得醋酸铜:
Cu(OH)2·CuCO3+4CH3COOH=2(CH3COO)2Cu·H2O+CO2↑+H2O
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量醋酸至固体不再溶解,趁热过滤。滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
回答下列问题:
(1)步骤(ⅰ)将研磨后混合物注入热水中反应,写出离子反应方程式______。
(2)碱式碳酸铜的制备需在热水中进行反应,且温度需控制在60℃左右,请解释原因______。
(3)在步骤(ⅰ)与步骤(ⅱ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤、趁热过滤与减压过滤,下列装置中没有使用到的有______。
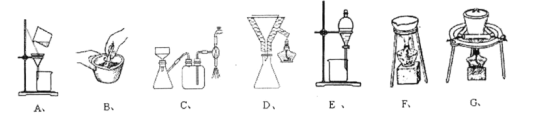
(4)步骤ⅱ中洗涤晶体的具体操作是______。
(5)最终称量所得的产品为8.0g,则产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含6.02×1023个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com