
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 17 | ①1s2 2s22p6 3s23p5 | ②3s23p5 | ③3 | ④ⅤⅡA |
| ⑤10 | 1s22s22p6 | ⑥2s22p6 | ⑦2 | ⑧0 |
| ⑨24 | ⑩1s2 2s22p6 3s23p63d5 4s1 | 3d54s1 | (11) | ⅥB |
分析 根据元素原子原子序数等于核外电子数,结合能量最低原理书写核外电子排布式,周期数等于原子核外电子层数,族等于最外层电子数.
解答 解:原子序数17,说明原子核外电子数为17,根据构造原理、洪特规则特例得到电子排布式为1s2 2s22p6 3s23p5,价电子排布式为3s23p5,最大能层数为3,说明处于第3周期,价电子数为7个,说明处于第ⅤⅡA族;
由电子排布式可知,原子序数=核外电子数=10,价电子排布式为2s22p6,最大能层数为2,价电子数为8,位于第二周期0族;
价电子排布式补齐前面的电子排布为1s2 2s22p6 3s23p63d5 4s1,原子序数=核外电子数=24,最大能层数为4,价电子数为6,位于第四周期ⅥB族;
故答案为:
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 1s2 2s22p6 3s23p5 | 3s23p5 | 3 | ⅤⅡA | |
| 10 | 2s22p6 | 2 | 0 | |
| 24 | 1s2 2s22p6 3s23p63d5 4s1 | 4 |
点评 本题考查了原子核外电子排布和周期表位置的关系,难度一般,根据元素的原子序数便可以写出原子的电子排布式,但是要注意洪特规则,既有些元素例如铜,铬等其价电子会重排,使得各个电子层达到全充满或者半充满状态,这样能量比较低,构型稳定.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
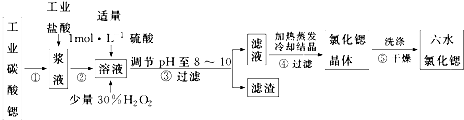
| SrSO4 | BaSO4 | Sr(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 | 2.6×10-39 | 4.87×10-17 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
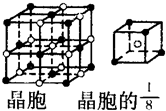 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水. ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心.该化合物的电子式是
”表示)均位于小正方体中心.该化合物的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p5 | D. | 3s1和3s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ①③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第3周期第ⅣA族 | |
| C. | 1 mol甲与足量的乙完全反应共转移1 mol电子 | |
| D. | 化合物甲中只有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
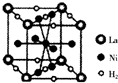 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. ④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.
④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4的摩尔质量是56 g | |
| B. | N4与N2互为同位素 | |
| C. | 相同质量的N4和N2含原子个数比为1:2 | |
| D. | N4与N2互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com