
分析 (1)①用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液,方程式为氧化物与酸反应,反应方程式为:V2O5+H2SO4═(VO2)2SO4+H2O,由VO2+中V元素化合价由+5得到(VO2)2SO4溶液中V元素化合价由+5,说明该反应是非氧化还原反应;
②VO2+中V元素化合价由+5价降低为VO+中+3价,H2C2O4中碳元素由+3价升高为CO2中+4价,H2C2O4是还原剂;化合价升降的最小公倍数为2,所以VO2+系数为1,H2C2O4系数为1,再根据原子守恒(电荷守恒)配平其它物质的系数,用单线桥还原剂中失电子的元素指向得电子的元素;
③由②可知当收集到标准状况下气体22.4升时,电子转移的数目为NA;
④盐酸酸化要考虑盐酸本身的负-价氯的还原性;
(2)利用化学平衡移动原理、化学平衡建立的标志、化学平衡常数、化学反应速率的相关知识进行分析解决.
解答 解:(1)①用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液,方程式为氧化物与酸反应,反应方程式为:V2O5+H2SO4═(VO2)2SO4+H2O,由VO2+中V元素化合价由+5得到(VO2)2SO4溶液中V元素化合价由+5,说明该反应是非氧化还原反应,
故答案为:V2O5+H2SO4═(VO2)2SO4+H2O;不是;
②VO2+中V元素化合价由+5价降低为VO2+中+4价,H2C2O4中碳元素由+3价升高为CO2中+4价,H2C2O4是还原剂;化合价升降的最小公倍数为2,所以VO2+系数为2,H2C2O4系数为1,根据原子守恒可知,VO2+,系数为2,CO2系数为2,H2O系数为2,然后通过电荷守恒,得空的一项是氢离子,配平后离子方程式为2VO2++H2C2O4+2H+═2VO2++2CO2+2H2O,故答案为:2、1、2H+、2、2、2H2O;
③由②可知当收集到标准状况下气体22.4升时,电子转移的数目为NA,当收集到标准状况下气体11.2升时,电子转移的数目为$\frac{11.2}{22.4}$NA=0.5NA,
故答案为:0.5NA;
④盐酸酸化要考虑盐酸本身的负-价氯的还原性,也就是VO2+ 和Cl2氧化性相对强弱,故选B;
(2)①SiO2(s)+4HF(g)?SiF4(g)+2H2O(g)+148.9kJ该反应为正反应体积减小的反应,增大压强,平衡向右移动,有SiF4(g)逸出,H2O(g)凝结为水,减小压强有SiO2(s)沉淀析出;故在地壳深处容易有SiF4、H2O 气体逸出,在地壳浅处容易有 SiO2沉积,故答案为:SiF4、H2O;SiO2;
②化学平衡常数只随温度的变化而变化,该反应为放热反应,平衡常数K值变大说明温度降低平衡右移,温度降低反应速率减小,平衡右移逆反应速率增大,故A、D正确,故答案为:AD;
③由容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,
则增加的质量为2.0L×0.12g/L=0.24g,由反应及元素守恒可知,每4molHF反应气体质量增加28+16×2=60g,
设参加反应的HF的物质量为x,
SiO2(s)+4HF(g)?SiF4(g)+2H2O(g)△m
4mol 1mol 2mol 60g
x 0.24g
$\frac{4mol}{x}$=$\frac{60g}{0.24g}$,解得x=0.016mol,
v(HF)=$\frac{△c}{△t}$=$\frac{0.016mol}{2L×8.0min}$=0.0010mol/(L•min)
故答案为:0.0010mol/(L•min).
点评 本题考查氧化还原反应配平和计算、化学反应速率和化学平衡,化学反应速率和化学平衡是化学基本理论的核心知识,是年年必考的内容,特别是有关化学反应速率和化学平衡的计算及影响因素、化学平衡常数的表达式及其计算是高考的重点.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:多选题
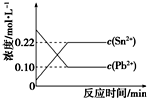 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| C. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 | |
| B. | 1 mol O2在反应中得到电子数一定为4 NA | |
| C. | 1 mol Cl2在反应中得到电子数不一定为2NA | |
| D. | 在2KClO3+4HC1(浓)═2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物,每生成1 mol Cl2转移2 NA 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
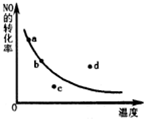 已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )
已知反应:2NO+O2?2NO2△H<0,如图曲线是表示其他条件一定时,反应中NO最大转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳 | B. | 苯、溴苯、四氯化碳 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O和Na2O2都属于碱性氧化物 | B. | KOH和Na2CO3都属于碱 | ||
| C. | NaHSO4和HNO3都属于酸 | D. | Na2O和SiO2都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在国民经济中占有很重要的地位.现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料.氨氧化法制硝酸是工业上制硝酸的主要方法.
氨在国民经济中占有很重要的地位.现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料.氨氧化法制硝酸是工业上制硝酸的主要方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com