
| A. | AlCl3溶液与过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4 Fe3++2H2O | |
| D. | CuSO4溶液与少量的Ba(OH)2溶液:Ba2+十SO42-═BaSO4↓ |
分析 A.不符合反应客观事实;
B.二氧化碳过量反应生成碳酸氢钙;
C.FeSO4酸性溶液暴露在空气中,被氧气氧化为硫酸铁;
D.漏掉铜离子与氢氧根离子的反应;
解答 解:A.AlCl3溶液与过量的浓氨水生成氯化铵和氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.向Ca(ClO)2溶液中通入过量的CO2,离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C.FeSO4酸性溶液暴露在空气中,被氧气氧化为硫酸铁,离子方程式:4Fe2++O2+4H+═4 Fe3++2H2O,故C正确;
D.CuSO4溶液与少量的Ba(OH)2溶液,离子方程式:Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式拆分,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入氮气 | B. | 扩大容器体积,减小压强 | ||
| C. | 加入适量催化剂 | D. | 适当升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
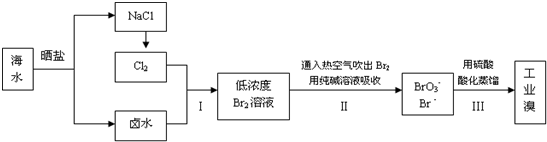
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先生成沉淀,后沉淀全部溶解 | |
| B. | 最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 | |
| C. | 当溶液中SO42-全部沉淀出来时,沉淀的总质量最大 | |
| D. | 当溶液中Al3+全部沉淀出来时,沉淀的总质量最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热法可以除去氯化铵中的少量碘单质 | |
| B. | 向试液中滴加双氧水和KSCN溶液,溶液变为红色,则试液中一定含Fe2+ | |
| C. | 向某固体中滴加稀硫酸,产生气体能使澄清石灰石变浑浊,则该固体一定是苏打或小苏打 | |
| D. | 向含少量硫酸铁的硫酸铜溶液中加入过量的氧化铜,过滤,得到纯净硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
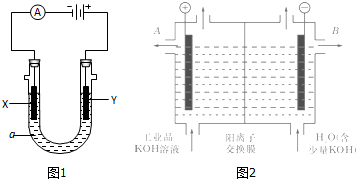
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com