
现代医学证明,人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着。碱式磷酸钙的化学式中除钙离子外还含有一个氢氧根离子和三个磷酸根离子(PO43-),则其化学
式正确的是( )
A.Ca2(OH)(PO4)3 B.Ca3(OH)(PO4)3 C.Ca4 (OH)(PO4)3 D.Ca5(OH)(PO4)3
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X | Y | |
| Z | W |
请回答下列问题:
(1)元素Z位于周期表中第________周期________族;
(2)这些元素的氢化物中,水溶液碱性最强的是______(写化学式);
(3)XW2的电子式为________;
(4)Y的最高价氧化物的化学式为________;
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为________。
和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质的结构式如下:
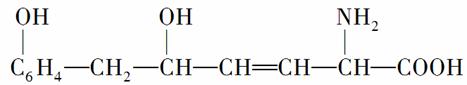 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )
A.1mol该物质最多可与1molH2加成
B.1mol该物质最多可与2mol NaOH完全反应
C.该物质可与醇发生酯化反应,也可与酸发生酯化反应
D.该物质既能与碱反应,又能与盐酸反应,也能与氯化氢反应
查看答案和解析>>
科目:高中化学 来源: 题型:
关于离子键、共价键的各种叙述,下列说法中正确的是( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素X的名称是____________。
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________。丙在一定条件下转化为甲和乙的反应方程式为__________________________________________。
(3)①化合物丁含X、Y、Z三种元素,0.1 mol/L丁溶液的pH为1,将丁与丙按物质的量之比为1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键
b.只含离子键
c.既含离子键,又含共价键
②常温下,戊的水溶液的pH________7(填“<”“=”或“>”),其原因是________________________________________________________________________
(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
120℃,在真空容器中加入碳酸铵固体,在一定条件下发生分解反应(NH4)2CO3===2NH3↑+CO2↑+H2O↑,所得混合气体的平均相对分子质量为( )
A.96 B.48 C.24g·mol-1 D.24
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)深圳大运会“虹”火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①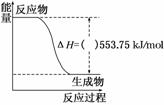 如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:
________________________________________________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ/mol
C2H5OH(g)===C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)
ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为_____ kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+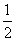 O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com