
 O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1 O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1| A.-441.8 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-260.4 kJ·mol-1 |
科目:高中化学 来源:不详 题型:填空题

 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。 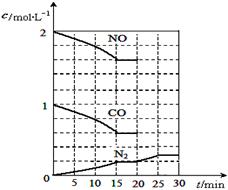
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol| 时间(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| n (CrO42—)(mol) | 0.01 | 8.0×10-4 | 5.4×10-4 | 5.0×10-4 | |
| n (Cr2O72—)(mol) | 0 | | 4.73×10-3 | | 4.75×10-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) ΔH1 回答下列问题。
CH3OH(g)+H2O(g) ΔH1 回答下列问题。 CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com