
| A. | 在Na2A、NaHA两溶液中,离子种类不相同 | |
| B. | 在溶质的物质的量相等的Na2A,NaHA两溶液中,阴离子总数相等 | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
分析 已知0.1mol•L-1的二元酸H2A溶液的pH=4,说明溶液为弱酸;
A、在Na2A、NaHA两溶液中,A2-离子水解,HA-存在电离和水解;
B、依据电荷守恒结合离子浓度计算判断;
C、依据溶液中电荷守恒计算判断;
D、A2-离子分步水解,溶液呈碱性.
解答 解:A、在Na2A、NaHA两溶液中,分析A2-离子水解,HA-存在电离和水解,离子种类相同,故A错误;
B、在溶质物质的量相等的Na2A、NaHA两溶液中,钠离子浓度不同,氢离子浓度不同,依据溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),阴离子总数不相等,故B错误;
C、在NaHA溶液中一定有电荷守恒,即c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),故C正确;
D、在Na2A溶液中,A2-离子分步水解,溶液呈碱性;一定有:c(Na+)>c(A2-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较方法,溶液中电荷守恒的分析判断,溶液中离子的特征性质和水解、电离,是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L 的NaCl溶液 | B. | 75mL 2mol/L的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L的KCl溶液 | D. | 75mL 1.5mol/L的CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
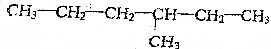
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 白磷的燃烧热为E2-E1 | |
| B. | 白磷分子中磷原子的杂化方式为sp3 | |
| C. | 1molP4O10中σ键的数目为16NA | |
| D. | 假设P-P、P-O、O=O的键能分别为a、b、c,则P=O的健能为(6a+5c-12b)/4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管的液面 | |
| D. | 称量氯化钠固体,氯化钠放在称量纸上,置于托盘天平的左盘,砝码放在天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量烧碱固体 | B. | 升高温度 | ||
| C. | 加少量冰醋酸 | D. | 加少量醋酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com