(2012?洛阳二模)钢铁生产中的尾气易造成环境污染,淸洁生产工艺可消减污染源并充分利用资源.已知:
①Fe
2O
3(s)+3CO(g)?2Fe(s)+3CO
2(g)△H=-25kJ/mol
②3Fe
2O
3(s)+CO(g)?2Fe
3O
4(s)+CO
2(g)△H=-47kJ/mol
③Fe
3O
4(s)+CO(g)?3FeO(s)+CO
2(g)△H=+19kJ/mol
(1)试计算反应:FeO(s)+CO(g)?Fe(s)+CO
2(g)△H=
-11kJ/mol
-11kJ/mol
.
(2)已知1092℃时(1)中反应的平衡常数为0.35,在1L的密闭容器中,投入7.2gFeO和0.1mol CO加热到1092℃并保持该温度,反应在t
1时达平衡.
①t
1时反应达平衡后,CO气体的体积分数为
74%
74%
.

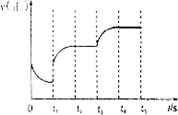
②该反应的正反应速率随时间变化情况如图甲所示,在t
1时改变了某种条件,反应在t
2时达平衡,改变的条件可能是
a
a
a.升高温度 b.增大CO的浓度
c.使用催化剂 d.增大压强
③如果在t
3时再增加CO
2的量,t
4时反应又处于新平衡状态,请在甲图上画出t
3~t
5时间段的v(正)变化曲线
.
(3)炼钢尾气净化后,可直接作熔融碳酸盐燃料电池(工作原理如图乙)的燃料.则负极的电扱反应为
CO+CO32--2e-═2CO2
CO+CO32--2e-═2CO2
.
(4)转炉炼钢,尾气中CO体积分数达58%-70%,某钢厂先用NaOH吸收CO生成甲酸钠,再吸收SO
2生成保险粉(Na
2S
2O
4),试写出甲酸钠和氢氧化钠混合溶液与SO
2生成保险粉同时生成二氧化碳的离子方程式
HCOO-+OH-+2O2═S2O42-+H2O+CO2
HCOO-+OH-+2O2═S2O42-+H2O+CO2
.
(5)目前我国大多数企业是将CO与水蒸气反应转换为H
2,然后用H
2与N
2反应合成氨,若收集到标准状况下3360m
3尾气,其中CO体积分数为60%,由于循环操作,假定各步转化率均为100%,理论上可获得NH
31.02
1.02
t.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案