
| A. | 丙烯 | B. | 1-丁炔 | ||
| C. | 丁烯 | D. | 2-甲基-1,3-丁二烯 |
分析 某气态烃1mol最多和2mol氯化氢发生加成反应,说明该烃分子中含有2个C=C键或1个C≡C;所得的1mol成产物又能与8mol氯气发生取代反应,最后得到一种只含碳氯元素的化合物,则加成产物中含有8个H原子,所以该气态烃应含有6个H原子,据此进行解答.
解答 解:1mol气态烃最多和2mol氯化氢发生加成反应,说明该烃分子中含有2个C=C键或1个C≡C,故A、C错误;
所得的1mol成产物又能与8mol氯气发生取代反应,最后得到一种只含碳氯元素的化合物,则该加成产物中含有8个H原子,所以该气态烃应含有6个H原子,故B正确、D错误;
故选B.
点评 本题考查了有机物分子式、结构简式的确定,题目难度不大,明确加成反应、取代反应原理为解答关键,注意熟练掌握常见有机物组成、结构与性质,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | H2O在高温下难分解,H2S在300℃即分解,说明氧的非金属性比硫强 | |
| B. | I-的还原性比Br-强,由此可推断溴的非金属性比碘强 | |
| C. | H2CO3的酸性比HClO的酸性强,说明碳的非金属性比氯强 | |
| D. | 已知反应:2NH3+3Cl2═N2+6HCl,由此可推断非金属性氯强于氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 还原性 H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | M与T形成的化合物能与NaOH溶液反应 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用贮氢金属和氢气反应生成氢化物的方法,为解决氢气的贮存问题指明了方向 | |
| B. | 科学家发现纳米硒除荧光灯的残汞效果非常好,可见纳米硒的非金属性比一般的硒强 | |
| C. | 在人类对酸碱认识的发展过程中,提出的酸碱质子理论不但适用于水溶液,在非水溶液和无水条件下也适用 | |
| D. | 为了使加酶洗衣粉有良好的洗涤效果,可先用温水溶解洗衣粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
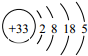 ,下列关于As的描述不正确的是( )
,下列关于As的描述不正确的是( )| A. | 位于第四周期,第ⅤA族 | B. | 属于非金属元素 | ||
| C. | 酸性:H3AsO4>H3PO4 | D. | 稳定性:AsH3<PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
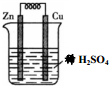
| A. | 铜片是正极 | B. | 锌片质量逐渐减少 | ||
| C. | 电子从锌片经溶液流向铜片 | D. | 正极的电极反应式:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
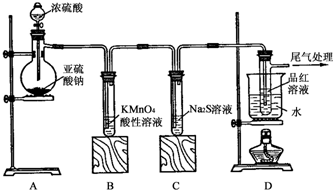
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com