
分析 [方案一]碳酸氢钠不稳定,受热易分解,根据加热前后固体质量变化,根据差量法求碳酸氢钠的质量,进而求得碳酸钠的质量分数;
(1)在灼烧固体样品时必须在坩埚中进行,根据使用坩埚加热使用到的仪器答题,给固体灼烧需用到的仪器有:酒精灯、三脚架、坩埚、泥三角、坩埚钳;
(2)加热恒重保证碳酸氢钠完全分解;
(3)当两次称量剩余固体的质量差不超过0.1g时,说明已经加热至恒重;
(4)若加热过程中有晶体迸溅出来,使得剩余的固体质量偏小,据此答题;
[方案二]碳酸钠和碳酸氢钠都和氢氧化钡反应生成碳酸钡沉淀,根据生成沉淀的质量来计算碳酸钠的质量分数.
(1)根据过滤操作考虑所需仪器;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀;
(3)洗涤沉淀在过滤器中加入蒸馏水浸没沉淀,待水自然流下,重复2-3次洗涤干净;
(4)判断沉淀是否洗涤干净的方法是检验沉淀上是否含有钡离子;
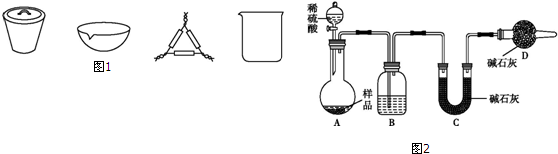
[方案三](1)由测定含量的实验可知,A中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定,盐酸易挥发,对实验产生干扰;
(2)结合反应定量关系和元素守恒计算得到物质的质量,来计算物质含量;
(3)二氧化碳气体不能全部进入C装置被吸收,需要添加一个吧二氧化碳气体赶入装置C的装置.
解答 解:[方案一](1)在灼烧固体样品时必须在坩埚中进行,要用泥三角支撑,
故答案为:坩埚、泥三角;
(2)实验原理是根据加热前后固体质量变化来计算碳酸氢钠,故应保证碳酸氢钠完全分解,加热恒重则碳酸氢钠完全分解,
故答案为:保证NaHCO3分解完全;
(3)实验中确定加热至恒重的方法是当两次称量剩余固体的质量差不超过0.1g时,说明已经加热至恒重,
故答案为:两次称量固体的质量差不超过0.1g;
(4)若加热过程中有晶体迸溅出来,使得剩余的固体质量偏小,即计算得碳酸氢钠的质量偏大,所以计算得样品中Na2CO3的质量分数偏小,
故答案为:偏小;
[方案二](1)过滤操作中用到的仪器有:铁架台(附铁圈)、烧杯、漏斗、玻璃棒、滤纸,过滤时需用玻璃棒引流,
故答案为:玻璃棒;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,
故答案为:取少量上层清液于一支试管中,滴加Ba(OH)2溶液,观察是否有白色沉淀生成;
(3)实验中洗涤沉淀的操作是:是向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2~3次,
故答案为:向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2~3次;
(4)判断沉淀是否洗涤干净的方法是检验沉淀上是否含有钡离子,操作为取少量最后一次洗涤沉淀的滤液于试管中,滴加一滴Na2SO4溶液,观察是否有白色沉淀生成,
故答案为:取少量最后一次洗涤沉淀的滤液于试管中,滴加一滴Na2SO4溶液,观察是否有白色沉淀生成;
[方案三](1)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小,
故答案为:浓H2SO4;防止空气中的水蒸气、二氧化碳进入C装置;不能;
(2)设NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
106x+84y=17.90
44x+44y=8.80
解得x=0.05mol
y=0.15mol
则样品中Na2CO3的质量分数为 $\frac{0.05mol×106g/mol}{17.90g}$×100%=29.6%,
故答案为:29.6%;
(3)实验装置还存在一个明显缺陷为装置中的二氧化碳不能被C全部吸收,则需设计一个装置将A、B中的CO2全部吹入C中吸收,
故答案为:缺少一套将A、B内的CO2气体驱赶到C里的装置.
点评 本题考查碳酸钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4;途径b:Cu$\stackrel{浓H_{2}SO_{4}}{→}$CuSO4 | |
| C. | 用金属钠可区分乙醇和乙醚 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 序 号 | 时间(min) 浓度(mol•L-1) 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 该反应是吸热反应,升温正、逆反应速率增大 | |
| B. | 实验3中 c3=1.2 mol•L-1 | |
| C. | 实验1与实验3比较,A的平衡转化率之比为1:2 | |
| D. | 实验2使用了催化剂,在0至10 min内平均速率υ(B)=0.02 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )
1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )| A. | 它的分子式是C6N10H2O2 | |
| B. | 该物质最多可以有18个原子处于同一个平面上 | |
| C. | 它可以与别的物质发生加成反应 | |
| D. | 因其含氮量高,有可能作炸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备苯甲醇和苯甲酸的化学原理是
实验室制备苯甲醇和苯甲酸的化学原理是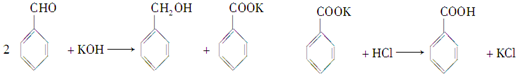
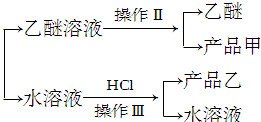
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com