
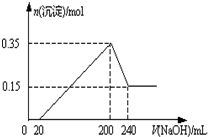
 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
| 1mol |
| 0.2L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为
用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、2:1 |
| C、略大于1:2 | D、略大于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、铁为阳极,H2SO4为电解液 |
| B、阴极发生的电极反应为6H2O+6e-═3H2↑+6OH- |
| C、阳极附近溶液pH变大 |
| D、铁失去3mol电子可以在阴极得到33.6L氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和等于1 |
| D、容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KHCO3 |
| B、K2CO3和Na2CO3 |
| C、MgCO3和Na2CO3 |
| D、Na2CO3和NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com