
| A. | 11 22 26 | B. | 13 15 38 | C. | 16 29 31 | D. | 18 21 31 |
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发制海盐的过程是化学变化 | |
| B. | 海洋中有丰富的潮汐能、波浪能等新型能源 | |
| C. | 海水中提取溴单质的过程涉及氧化还原反应 | |
| D. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析发等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 溶液中加入盐酸,再滴加BaCl2溶液 | 先无现象,后产生白色沉淀 | 原溶液中有SO42- |
| B | 向两份蛋白质溶液中分别滴加饱和Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Mg电极溶解 | Mg比Al金属活动性强 |
| D | 向稀HNO3溶液中加入过量铁粉充分反应后,滴入KSCN溶液 | 溶液变为血红色 | 和HNO3具有氧化性,能将Fe氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前元素周期表有7个周期 | B. | 元素周期表有8个主族 | ||
| C. | ⅢA族元素全部是金属元素 | D. | 非金属元素都在ⅣA~ⅤⅡA和0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
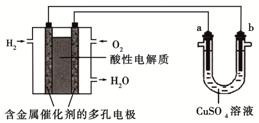
| A. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| B. | a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,a极上产生的O2与电池中消耗的H2的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
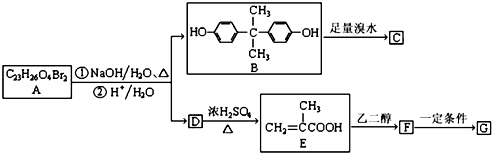
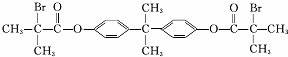
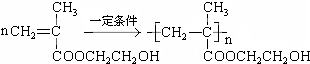 .
.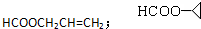 .
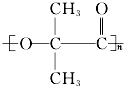
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com