
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.实现化石燃料清洁利用,就无需开发新能源
C.为提高农作物的产量和质量,应大量使用化肥和农药
D.将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法正确的是( )
A. 苯能使酸性高锰酸钾溶液褪色
B. 苯分子具有平面正六边形结构,12个原子在同一平面上,对位上的4个原子在一条直线上
C. 苯能使溴水褪色,是发生了取代反应
D. 苯不含有碳碳双键故不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质的比较,不正确的是
A.稳定性:H2O>NH3 B.碱性:NaOH>Al(OH)3
C.氧化性:F2>Cl2 D.酸性: H2SO4>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为 (填化学式)。
③NaH2PO2为 (填“正盐”或“酸式盐”)
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一。
(1)氨催化氧化法是工业制硝酸的主要方法。
已知:2NO(g)+3H2(g)![]() 2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
(2)恒容密闭容器中进行合成氨反应N2(g) +3H2(g) ![]() 2NH3(g) △H4 = - 92. 4 kJ·mol-1,
2NH3(g) △H4 = - 92. 4 kJ·mol-1,
ΔS=-198.2Jmol-1K-1。其化学平衡常数(K)与温度的关系如下表:
温度/K | 398 | 498 | … |
平衡常数(K) | K1 | K2 | … |
K1 K2(填“>”或“<”),请分析,298K时,合成氨反应能否自发进行 。
(3) 向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。下列说法正确的是 (填字母)。
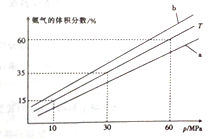
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为 。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为 。
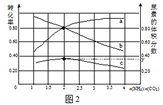
(5)氨碳比[n(NH3)/n(CO2)]对合成尿素的反应:2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C+和B3-具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的原子个数为1:1的化合物,是人们生活的必需品。回答下列问题:
(1) 五种元素中,原子半径最大的是______,非金属性最强的是______(填元素符号)。
(2 )由A和D、E所形成的共价型化合物中,热稳定性差的是________(用化学式表示)。
(3) A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________,
其中存在的化学键类型为________,用电子式表示A和B其形成化合物过程________。
(4) D最高价氧化物的水化物的化学式为____________。
(5) 单质C在充足的单质E中燃烧,反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光电池是发展性能源。一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl (s)![]() Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-=Cl-(aq),若将光源移除,电池会立即恢复至初始状态。下列说法不正确的是
Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-=Cl-(aq),若将光源移除,电池会立即恢复至初始状态。下列说法不正确的是
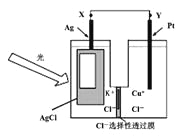
A. 光照时,电流由X流向Y
B. 光照时,Pt电极发生的反应为:2Cl-+2e-=Cl2↑
C. 光照时,Cl-向Pt电极移动
D. 光照时,电池总反应为:AgCl(s)+Cu+(aq)![]() Ag(s)+Cu2+(aq)+Cl-(aq)
Ag(s)+Cu2+(aq)+Cl-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
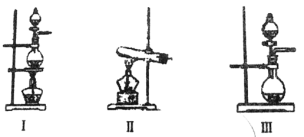
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制备氧气 | H2O2→O2 | __________________ |
② | 制备二氧化硫 | Na2SO3→SO2 | __________________ |
③ | 制备氯气 | HCl→Cl2 | __________________ |
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是__________________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是__________________;
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
(3)某学习小组设计了如图实验,将氯气依次通过下列装置以验证氯气的性质:

①通入氯气后,A中的现象是__________________,整套实验装置存在的明显缺陷是__________________;
②C装置中发生反应的离子方程式为__________________。
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化。具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化。你认为__________________ (填“是”或“否”)合理?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
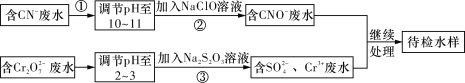
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:_________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每消耗0.4 mol Cr2O72-转移________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是:___________________,___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com