
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,XO4-为氧化剂,其中X元素化合价降低,根据氧化还原反应中得失电子守恒计算.
解答 解:该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,化合价从+4升到+6价失电子数=0.1mol/L×0.015L×2=0.003mol,
XO4-为氧化剂,其中X元素化合价降低,开始为+7价,得失电子守恒,X元素化合价变化为$\frac{0.003mol}{0.01×0.1}$=3,即从+7价降到+4价.
故选D.
点评 本题考查学生氧化还原反应中的电子守恒思想的应用知识,正确判断反应前后的化合价变化是解题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2 NA | |
| B. | 0.1 mol/L (NH4)2SO4溶液与0.2 mol/L NH4Cl溶液中的NH4+数目相同 | |
| C. | 标准状况下,H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
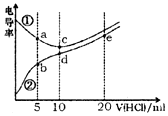 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH•H2O)]=l.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH•H2O)]=l.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液中:c[(CH3)2NH2+]>c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃时,饱和NaCl溶液的溶解度:S=$\frac{5850c}{ρ-58.5}$g | |
| B. | 此溶液中NaCl的质量分数为:$\frac{58.5×c}{ρ×1000}$×100% | |
| C. | 20℃时,密度小于ρ g•cm-3的NaCl溶液是不饱和溶液 | |
| D. | 温度低于20℃时,饱和NaCl溶液的浓度小于cmol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应是由于反应物的总能量比生成物的总能量低 | |
| B. | 放热反应的△H<0 | |
| C. | 需要加热才能发生反应一定是吸热反应 | |
| D. | 酸碱中和反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气通入氯化亚铁溶液:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:HCO3-、Na+、ClO-、NO3- | |
| B. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| C. | 水电离出的c(H+)=10-4 mol/L的溶液:Na+、K+、SO42-、CO32- | |
| D. | 使石蕊呈红色的溶液:NH4+、NO3-、AlO2-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作呼吸面具中氧气的来源 | |
| B. | 硅酸钠可作木材防火剂的原料 | |
| C. | 二氧化硫在葡萄酒中起漂白作用 | |
| D. | 还原铁粉可用于食品包装袋内的脱氧剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com