
黄铜矿![]() 是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为
![]()
![]()
![]()
若![]() 中
中![]() 的化合价为
的化合价为![]() ,反应中被还原的元素是 (填元素符号)。
,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程产生大量![]() 。下列处理方案中合理的是 (填代号)。
。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制![]() d.用浓硫酸吸收
d.用浓硫酸吸收
(3)过二硫酸钾![]() 具有强氧化性,可将
具有强氧化性,可将![]() 氧化为
氧化为![]() :
:
![]()
通过改变反应途径,![]() 、
、![]() 均可催化上述反应。试用离子方程式表示
均可催化上述反应。试用离子方程式表示![]()
对上述反应催化的过程 、 。(不必配平)
科目:高中化学 来源: 题型:阅读理解
| ||
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
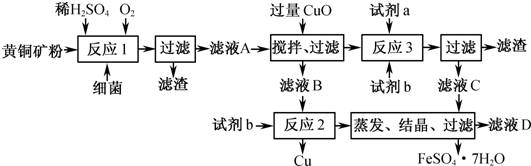
| ||
| ||
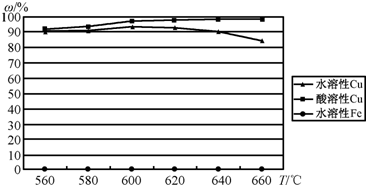
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com