
分析 1.00g甲烷完全燃烧生成液态水时能放出55.65kJ的热量,16g甲烷(1mol)完全燃烧生成液态水时能放出16×55.65kJ=890.4kJ的热量,根据热化学方程式的系数的意义以及书写方法来回答.
解答 解:1.00g甲烷完全燃烧生成液态水时能放出55.65kJ的热量,16g甲烷(1mol)完全燃烧生成液态水时能放出16×55.65kJ=890.4kJ的热量,故甲烷燃烧生成液态水时的热化学反应方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.4kJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.4kJ•mol-1.
点评 本题考查甲烷的热化学方程式的书写,热化学方程式系数的意义等知识,难度不大.


科目:高中化学 来源: 题型:解答题
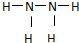 ,过氧化氢的电子式
,过氧化氢的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s 浓度(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.10 | c1 | 0.05 | c3 | a | b |
| c(NO2) | 0.00 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOOH | CaF2 | Al2O3 | SO2 |
| 物质 | M | N | Q | P |
| 反应前质量(g) | 50 | 1 | 3 | 12 |
| 反应后质量(g) | X | 26 | 3 | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com