
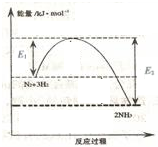
 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
分析 (1)由图可知,氮气、氢气总能量高于氨气能量,该反应为放热反应;
(2)①根据v=$\frac{△c}{△t}$计算v(N2),再根据速率之比等于其化学计量数之比计算v(H2);
②由表中数据可知,40min到达平衡,根据氮气的物质的量计算分解的氨气的物质的量,进而计算平衡时氨气的物质的量,再根据c=$\frac{n}{V}$计算平衡时氨气的浓度;
③等效为压强增大一倍,增大压强,反应速率加快.
解答 解:(1)由图可知,氮气、氢气总能量高于氨气能量,该反应为放热反应,
故答案为:放热;
(2)①前20min内,生成氮气为0.016mol,则v(N2)=$\frac{\frac{0.016mol}{2L}}{20min}$=4×10-4mol/(L.min),速率之比等于其化学计量数之比,则v(H2)=3v(N2)=3×4×10-4mol/(L.min)=1.2×10-3mol/(L.min),
故答案为:1.2×10-3mol/(L.min);
②由表中数据可知,40min到达平衡,平衡时分解的氨气的物质的量为0.04mol×2=0.08mol,故平衡时氨气的物质的量为0.1mol-0.08mol=0.02mol,平衡时氨气的浓度为$\frac{0.02mol}{2L}$=0.01mol/L,
故答案为:0.01mol/L;
③在1L密闭容器中加入催化剂并通入0.1mol NH3(g),等效为再原平衡的基础上压强增大一倍,增大压强,容器中的反应速率比原容器的快,
故答案为:快.
点评 本题考查化学反应中能量平衡、化学反应速率计算及影响因素、化学平衡有关计算,比较基础,注意对基础知识的理解掌握.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ?①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
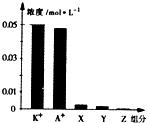 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | 该混合溶液pH=7.0 | B. | 原HA溶液中:c(HA)>c(H+)>c(A-) | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 混合溶液中:c(X)+x(A-)=c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti质子数相同 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti质量数不同,不能互称同位素 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
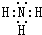 ,A在周期表中的位置第一周期第ⅠA族.
,A在周期表中的位置第一周期第ⅠA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对二甲苯的一氯代物有三种 | |
| B. | 对二甲苯的所有原子可能在同一平面内 | |
| C. | 对二甲苯能使溴水和酸性高锰酸钾因发生化学反应而褪色 | |
| D. | 在一定条件下,对二甲苯能发生氧化反应、还原反应、取代反应、加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金刚石比石墨稳定性好 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| D. | 断裂1 mol石墨中的化学键吸收的能量比断裂1 mol金刚石中的化学键吸收的能量小1.9 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com