
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)

①如果加入蒸馏水,应加_________mL;
②如果加入pH=10的NaOH溶液,应加_________mL;
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、 “抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为____________。
【答案】900 1000 促进 ![]() >
> ![]()
【解析】
(1)①先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;
②先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;
(2)盐类水解促进水的电离;
(3)弱酸的电离平衡常数越大,酸性越强;
(4)等浓度的CH3COOH溶液和NaOH溶液等体积混合,酸过量;
(5)酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-,则根据较强酸制备较弱酸的原理判断。
(1)①pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=0.001mol/L×(0.1+V2)L,V2=![]() -0.1L=0.9L=900mL;
-0.1L=0.9L=900mL;
②pH=10的氢氧化钠溶液中c(OH-)=0.0001mol/L,
设pH=10的氢氧化钠的体积为yL,则0.01mol/L×0.1L+0.0001mol/L×yL=0.001mol/L×(0.1+y)L,y=1L=1000mL;
(2)氯化铵溶于水NH4+水解,促进水的电离,因此25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进;
(3)弱酸的电离平衡常数越大,酸性越强。则根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-。又因为酸性越弱,相应的钠盐越容易水解,溶液的碱性越强,因此25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为②Na2CO3溶液>①NaCN溶液>③CH3COONa溶液;
(4)等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(H+)<c(OH-)由电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),得c(Na+)>c(CH3COO-);
(5)酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-,则根据较强酸制备较弱酸的原理可知,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 晶体中与每个K+距离最近的O2-有6个
C. 晶体中,所有原子之间都以离子键相结合
D. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g) + 2B2(g)![]() 2AB2(g) ΔH < 0,列说法正确的是 ( )
2AB2(g) ΔH < 0,列说法正确的是 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度有利于反应速率增加,从而缩短达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.反应N2(g)+3H2(g)![]() 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是
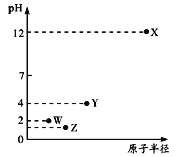
A. 简单离子半径: X>Y>Z>W
B. W的单质在常温下是黄绿色气体
C. 气态氢化物的稳定性: Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对化学反应描述的观点中正确的有几项:①放热反应在常温下均能自发进行;②电解过程中,化学能转化为电能而“储存”起来;③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;⑤盐类均能发生水解反应;⑥相同温度下,同一反应的化学平衡常数的大小与化学反应方程式的书写有关( )
A.1项B.2项C.3项D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成分的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入_______(填名称),溶液变蓝,则证明苹果中含有淀粉。
(2)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程图,试回答下列问题:
![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
①写出化学方程式,并注明反应类型。
B与醋酸反应:____________________________,属于______________反应。
B→C____________________________,属于____________________________反应。
②可用于检验A的试剂是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
(1)硫酸酸化的KMnO4能与Na2C2O4溶液反应生成Mn2+和CO2,该反应的离子方程式为__________;
(2)分别使10 mL pH=3的H2C2O4溶液和100 mL pH=4的H2C2O4溶液全部转化为Na2C2O4,所需等浓度的NaOH溶液的体积为V1和V2,则V1_____V2(填“>”“<”或“=”)
(3)常温下,用0.1000 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:![]()

①该草酸溶液的物质的量浓度为__________;
②a点所示溶液中各离子的浓度由大到小的顺序为_________________;
(4)已知:某温度时,Ksp(FeC2O4)=2.0×10-7,Ksp(CaC2O4)=2.5×10-9。
①此温度下,CaC2O4饱和溶液的物质的量浓度为________;
②此温度下,向Na2C2O4溶液中加入FeCl2与CaCl2,当两种沉淀共存时,溶液中c(Fe2+):c(Ca2+)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列________________物质相似。
a.75%酒精 b.双氧水 c.苯酚 d.“84”消毒液(NaClO溶液)
(2)粉碎的目的是________________,操作Ⅰ的名称是________________
(3)上述流程中可以循环使用的物质有石灰、CO2、_________和__________(写化学式)。
(4)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是____________。
(5)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com