
| A、向饱和的碳酸钠溶液中通入CO2气体,没有明显实验现象 |
| B、向久置于空气中的FeSO4溶液中滴加NaOH溶液,产生大量白色沉淀 |
| C、在空气中用酒精灯加热铝箔,铝箔熔化,失去光泽,但熔化的铝并不滴落 |
| D、向某溶液中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明该溶液中一定含有CO32- |


科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| B、对有机物分子红外光谱图的研究有助于确定有机物分子中的基团 |
| C、分子式C4H10表示的物质必是纯净物 |
D、有机物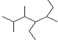 的名称:2,3,5-三甲基-4-乙基庚烷 的名称:2,3,5-三甲基-4-乙基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组
(1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- | ||
| 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、0.1 mol/L NH4Cl与0.1 mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、向40 mL 8 mol/L的稀硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com