
下列说法正确的是( )
|
| A. | 将Cl2通人FeBr2溶液中,溶液颜色变黄,则Fe2+被氧化,Br﹣不一定参加了反应 |
|
| B. | CO2、SO3、NO2和水反应均能生成酸,都属于酸性氧化物 |
|
| C. | 0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量.其燃烧热的热化学方程式为CH4 (g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890kJ/mol |
|
| D. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| 氯、溴、碘及其化合物的综合应用;酸、碱、盐、氧化物的概念及其相互联系;热化学方程式.. | |
| 专题: | 物质的分类专题;化学反应中的能量变化;卤族元素. |
| 分析: | A、氯气具有氧化性,能将溴离子、亚铁离子氧化,还原性顺序是Fe2+>Br﹣,据此回答判断; B、酸性氧化物是能和碱之间反应生成盐和水的氧化物; C、燃烧热是完全燃烧1mol物质生成最稳定产物时放出的热量; D、明矾具有净水作用,漂白粉具有杀菌消毒作用. |
| 解答: | 解:A、氯气具有氧化性,能将溴离子、亚铁离子氧化,还原性顺序是Fe2+>Br﹣,将Cl2通人FeBr2溶液中,溶液颜色变黄,则Fe2+被氧化为三价铁,Br﹣不一定参加了反应,故A正确; B、CO2、SO3是能和碱之间反应生成盐和水的氧化物,属于酸性氧化物,但是NO2不是酸性氧化物,故B错误; C、甲烷燃烧热的热化学方程式为CH4 (g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ/mol,应该生成液态水,故C错误; D、明矾中的铝离子水解的到氢氧化铝胶体具有净水作用,漂白粉具有氧化性,因而有杀菌消毒作用,两者的作用原理不相同,故D错误. 故选A. |
| 点评: | 本题涉及酸性氧化物、燃烧热的概念以及物质的性质和应用等知识的考查,难度不大. |


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________(填字母)。
A.制汽轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)画出N的原子结构示意图:________。根据元素周期律知识,请写出氮化硅的化学式:________________________________________________________________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式:______________________________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列转化关系中,B、D都是淡黄色固体,且D和A都是单质。
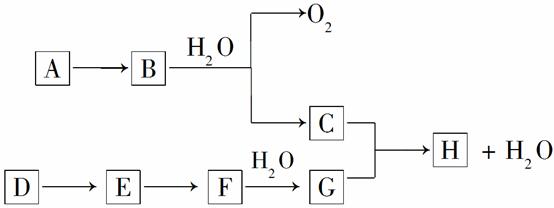
(1)写出下列物质的化学式:A__________,G__________,H__________。
(2)写出E→F,F→G的化学方程式:
E→F________________________________________________________________________;
F→G________________________________________________________________________。
(3)写出E和足量的C溶液反应的离子方程式____________________。
(4)0.5千克含D 48%的某物质能转化为含G 98%的溶液多少千克(所含的D有98%转化为G)?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验可行或叙述正确的是( )
①不能用闻气味的方法区分丝织品和棉织物
②蔗糖加稀硫酸的水解液,再加新制Cu(OH)2悬浊液共热会产生砖红色沉淀
③乙酸乙酯、油脂在碱性条件下水解均可制肥皂
④用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
⑤金属的冶炼都是置换反应
⑥漂白粉、玻璃、脂肪是混合物,水银、明矾、蔗糖是纯净物
⑦盐酸、BaSO4是强电解质,氨水是弱电解质,苯、四氯化碳是非电解质
⑧符合n(C):n(H)=n:(2n+2)的物质一定是烷烃
⑨煤中含苯及甲苯,可以用先干馏后分馏的方法把它们分离出来
⑩离子键只存在于离子化合物中,共价键只存在于共价化合物和离子化合物中.
|
| A. | ⑤⑥⑧⑨⑩ | B. | ①⑥ | C. | ①⑤⑥⑨⑩ | D. | ②③⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
|
| A. | 反应中硫元素被氧化,所有铁元素均被还原 |
|
| B. | 氧化剂是Fe3+,氧化产物是Cu2+ |
|
| C. | 反应中转移电子的物质的量为xmol |
|
| D. | 反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y﹣x)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑可用于地下水脱氮,实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5mol/L盐酸中进行预处理.
Ⅱ、30min后,用去离子水反复冲洗,至冲洗后液体的pH为中性.在N2保护下烘干备用.
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液.
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中.
请回答:
(1)盐酸溶解Fe2O3的离子方程式是 .
(2)烘干时需要在N2保护下进行的原因是 .
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是 .
(4)将酸性条件下,铁与NO3﹣反应的离子方程式补充完整:
Fe+ NO3﹣+ + ═ Fe2++ NH4++ .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略)。
A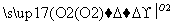 B
B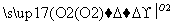 C
C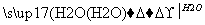 D
D
下列说法不正确的是( )
A.若A为非金属单质,则它与Mg反应的产物中阴阳离子个数比可能为2:3
B.若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第ⅣA族
C.不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化
D.若A是共价化合物,0.1 mol A分子中含有的电子数可能为NA(NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为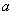 %和
%和 %的两种溶液,则
%的两种溶液,则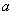 和
和 的关系是
的关系是
A.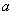 =
= B.
B.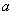 >
> C.
C.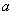 <
< D.无法确定
D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com