

| n |
| V |
| 2.87g |
| 143.5g/mol |
| 0.02mol×58.5g/mol |
| 5.0g |
| 0.02mol |
| 0.05L |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
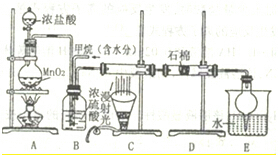
| V(Cl2) |
| V(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO--干燥剂 |
| B、Na2O2--供氧剂 |
| C、Al2O3--铝热剂 |
| D、KAl(SO4)2.12H2O--净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
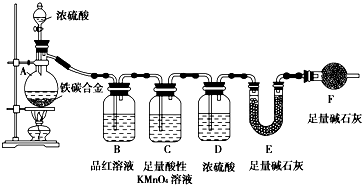 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
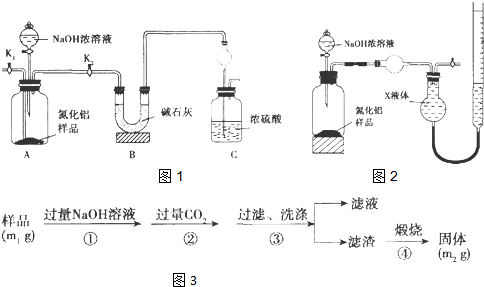

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2COOCH2CH(CH3)2 |
| B、CH3 COOCH(CH3)2 |
| C、CH3 COOCH2CH2CH2OOCCH3 |
| D、CH3 COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以油脂为原料提取甘油,用作护肤品中的保湿剂 |
| B、以动物的毛发为原料提取氨基酸 |
| C、以淀粉作原料提取淀粉酶,用作催化剂 |
| D、以棉花为原料制备火棉和胶棉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com