
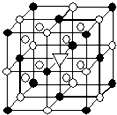
 冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )
冰晶石(化学式为Na3AlF6)的结构单元如图所示,已知冰晶石熔融时电离方程式为Na3AlF6=3Na++AlF6-.●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是( )| A. | Na+ | B. | Al3+ | C. | F- | D. | AlF6- |
分析 根据冰晶石电离方程式知,该物质的构成微粒是Na+、AlF6-,且二者个数之比为3:1,●个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○个数=8+12×$\frac{1}{4}$=11,根据阴阳离子个数之比确定▽所代表的微粒.
解答 解:根据冰晶石电离方程式知,该物质的构成微粒是Na+、AlF6-,且二者个数之比为3:1,●个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○个数=8+12×$\frac{1}{4}$=11,要使该晶胞中Na+、AlF6-为3:1,则▽所代表的微粒应该是○,为Na+,故选A.
点评 本题考查晶胞计算,侧重考查学生计算及空间想象能力,明确各个原子被几个晶胞占有是解本题关键,采用均摊法解答,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制备金属钠 | B. | 加热分解Ag2O制备金属银 | ||
| C. | Fe2O3与CO高温下反应制备金属铁 | D. | Cu2S与O2高温下反应制备金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 硝酸溶液和烧碱溶液反应 | ||
| C. | 醋酸和KOH溶液反应 | D. | 盐酸和氢氧化铁反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00[来 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应--二氧化碳 | B. | 酸雨--二氧化碳 | ||
| C. | 白色污染--废塑料制品 | D. | 臭氧层破坏--氟氯代烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com