
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
分析 经氢氧化钠溶液处理后,容器内几乎变为真空,说明气态烃和氧气完全反应,设该烃的分子式为CxHy,点燃爆炸后,又恢复到起始温度,此时容器内的压强减至原压强的$\frac{1}{3}$,剩余气体为CO2,生成的二氧化碳的分子物质的量是烃与氧气总物质的量的$\frac{1}{3}$,根据燃烧的通式进行计算.
解答 解:烃燃烧后的气体经NaOH溶液吸收,容器几乎成真空,说明烃和O2完全反应生成CO2和液态水,
设此碳氢化合物的化学式为CxHy,则:
4CxHy+(4x+y)O2$\stackrel{点燃}{→}$4xCO2+2yH2O(l)
根据题意可知:4+4x+y=3×4x,
整理可得:8x=4+y,即
若x=1,则y=4,为甲烷(CH4),
若x=2,则y=12,不存在该物质,
若x=3,则y=20,不存在该物质,
根据分析可知,该气态烃只能为甲烷,即A符合,
故选A.
点评 本题考查有机物分子式的确定,题目难度中等,明确反应前后压强的变化是解答该题的关键,易错点为根据燃烧的进行计算,注意认真体会.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 3mol | C. | 4.5mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
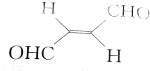 ,下列叙述正确的有( )
,下列叙述正确的有( )| A. | 分子间可形成氢键 | B. | 分子中既有极性键又有非极性键 | ||
| C. | 分子中有7个σ键和1个π键 | D. | C原子的杂化方式是sp2和sp3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com