
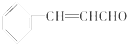
| A. | 煮沸肉桂醛与新制Cu(OH)2的混合物有砖红色沉淀生成 | |
| B. | 电解肉桂醇制得的肉桂醛在电解池的阳极生成 | |
| C. | 仅用新制银氨溶液和溴水不能鉴别肉桂醛中的碳碳双键 | |
| D. | 13.2g肉桂醛分子中含有碳碳双键数目为0.4NA |
分析 该有机物中含有苯环、碳碳双键和醛基,具有苯、烯烃和醛的性质,能发生加成反应、取代反应、氧化反应、
银镜反应等据此分析解答.
解答 解:A.该物质中含有醛基,与新制Cu(OH)2混合煮沸会生成砖红色的Cu2O沉淀,故A正确;
B.肉桂醇到肉桂醛是“去氢”氧化过程,由电解池的阳极发生氧化反应知肉桂醛在阳极生成,故B正确;
C.检验肉桂醛中的醛基方法为:少量肉桂醛先与足量银氨溶液充分反应,过滤后,用稀硝酸酸化滤液,再加溴水,溴水褪色说明含有醛基;C中没有提供稀硝酸,故不能鉴别,故C正确;
D.肉桂醛的相对分子质量为132,13.2g肉桂醛就是0.1mol,含0.1mol碳碳双键,数目为0.1 NA.苯环中没有碳碳双键,苯环中的碳碳键是介于单键和双键之间的独特的键,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、醛的性质,注意醇制取醛的方法,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | Na2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 加硝酸后的白色沉淀不一定是BaSO4 | |
| D. | 此实验不能确定Na2SO3是否部分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 4NH3+6NO$?_{△}^{催化剂}$5N2+6H2O | D. | NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
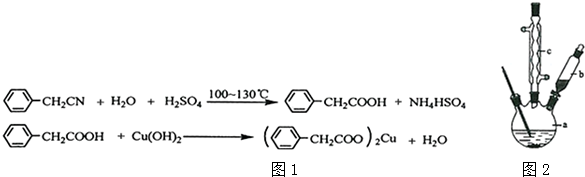
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
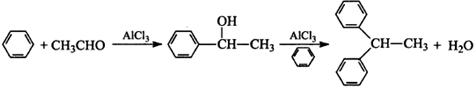
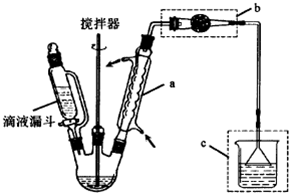
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
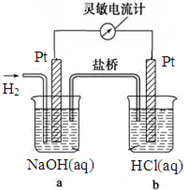 如图向a中通入H2,发现灵敏电流计指针发生偏转,持续通入H2可观察到b中铂电极表面有少量气泡产生,负极反应式为H2-2e-+2OH-=2H2O,电池的总反应为HCl+NaOH=H2O+NaCl.
如图向a中通入H2,发现灵敏电流计指针发生偏转,持续通入H2可观察到b中铂电极表面有少量气泡产生,负极反应式为H2-2e-+2OH-=2H2O,电池的总反应为HCl+NaOH=H2O+NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com