
���³�ѹ��,��a mol CO2����ͨ��1 L b mol/L��NaOH��Һ��,���ж�������Һ����������ȷ���ǣ� ��
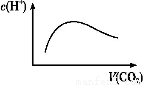
A.��a=2bʱ,����CO2�����ͨ��,��Һ����ˮ�������c(H+)����ͼ�仯��ϵ
B.��a=bʱ,������Һ�д���:c(OH-)+c(C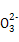 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
C.��2a=bʱ,������Һ�д���:c(Na+)��c(C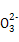 )��c(OH-)��c(HC
)��c(OH-)��c(HC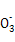 )��c(H+)
)��c(H+)
D.��1/2��a/b��1ʱ,������Һ��һ������:c(Na+)=c(C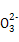 )+c(HC
)+c(HC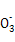 )+c(H2CO3)
)+c(H2CO3)
D
����������a=2bʱ,��CO2��ͨ��CO2��NaOH��Ӧ������Na2CO3,�̶�����NaHCO3,��������CO2��H2CO3��ʽ��������Һ��,�����ε�ˮ��ٽ�ˮ�ĵ���,����������ˮ�ĵ���,A��;��a=bʱ,CO2��NaOH��Ӧ����NaHCO3,���������غ��֪c(OH-)=c(H2CO3)+[c(H+)-c(C )],B��;��2a=bʱ,CO2��NaOH��Ӧ����Na2CO3,c(OH-)��C
)],B��;��2a=bʱ,CO2��NaOH��Ӧ����Na2CO3,c(OH-)��C ˮ���ˮ�ĵ����������ṩ,��c(OH-)��c(HC
ˮ���ˮ�ĵ����������ṩ,��c(OH-)��c(HC ),C��;��1/2��a/b��1ʱ,CO2��NaOH��Ӧ����Na2CO3��NaHCO3,���������غ�,c(Na+)��c(C
),C��;��1/2��a/b��1ʱ,CO2��NaOH��Ӧ����Na2CO3��NaHCO3,���������غ�,c(Na+)��c(C )+c(HC
)+c(HC )+c(H2CO3)��
)+c(H2CO3)�� c(Na+),D����
c(Na+),D����


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ����ר��ͻ�� ר��Ż�ѧ��Ӧ���ʻ�ѧƽ����ϰ���������棩 ���ͣ�ѡ����
��ӦN2O4(g)  2NO2(g)����H����57 kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���ǣ� ��
2NO2(g)����H����57 kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���ǣ� ��
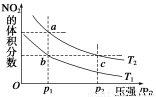
A��a��c����ķ�Ӧ���ʣ�a��c
B��a��c�����������ɫ��a�cdz
C��a��b���������ƽ����Է���������a��b
D��b��c���㻯ѧƽ�ⳣ����b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ����ר��ͻ�� ר��һ���ʵ�������ʺͷ�����ϰ���������棩 ���ͣ�ѡ����
�����й�Һ̬������̼�����(��ͼ��ʾ)��˵������ȷ���ǣ� ��
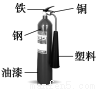
A�������֡�ͭ�����ڽ�������
B�����������л��߷��Ӳ���
C��ͭ��ϡ����ķ�Ӧû������ϡ����ķ�Ӧ���ң��ʽ����ԣ�ͭ����
D����ĭ������е�ҩƷAl2(SO4)3��NaHCO3�ֱ������κͼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��8�绯ѧԭ����ϰ���������棩 ���ͣ������
���ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��,����ӡˢ��·�塣ij����ʦΪ�˴ӷ�Һ�л���ͭ,���»��FeCl3��Һ,���������ʵ�鲽��:

д��һ����֤����ԭ��Fe��Cuǿ�����ӷ���ʽ: ��
�÷�Ӧ����ͼ���� �з����������������Ӧ���һ��ԭ���,�ڷ����л�������װ��ͼ(����缫���ơ��缫���ϡ��������Һ)��
|
�������̻��յ�ͭ�Ǵ�ͭ,Ϊ�˻�ø�����ͭ������е�⾫����д����⾫��ʱ�������ϼ���Ҫ�ĵ缫��Ӧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��8�绯ѧԭ����ϰ���������棩 ���ͣ�ѡ����
����������ȷ���ǣ� ��
A.���ʱ,ͨ���Ѵ��ƵĽ�����Ʒ������
B.�ȼҵ�ǵ�����ڵ�NaCl,�������ܵõ�Cl2
C.��ͼ�е�����Zn������Cu,�����е�Cl-����CuSO4��Һ
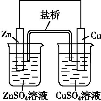
D.����ȼ�ϵ��(���Ե����)��O2ͨ������,�缫��ӦΪ:O2+4H++4e-=2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��7�������Һ��ϰ���������棩 ���ͣ�ѡ����
������,��100 mL 0.01 mol��L-1 HA��Һ����μ���0.02 mol��L-1 MOH��Һ,ͼ����ʾ���߱�ʾ�����Һ��pH�仯���(��Һ����仯���Բ���)������˵����,��ȷ���ǣ� ��

A.HA����ΪһԪ����
B.MOHΪһԪǿ��
C.N��ˮ�ĵ���̶�С��K��ˮ�ĵ���̶�
D.��K���Ӧ����Һ��pH=10,����c(MOH)+c(M+)=0.01 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��6��ѧ��Ӧ���ʺͻ�ѧƽ����ϰ���������棩 ���ͣ�ѡ����
��֪�ϳɰ���ӦN2(g)+3H2(g) 2NH3(g) ��H=-92.20 kJ��mol-1,��ij�¶���2 L���ܱ������н���,�����������:
2NH3(g) ��H=-92.20 kJ��mol-1,��ij�¶���2 L���ܱ������н���,�����������:
ʱ��(h) ���ʵ���(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | n5 |
H2 | 4.50 | 4.20 | 3.60 | n4 | n6 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
����˵����ȷ���ǣ� ��
A.��Ӧ3 h��,��Ӧ����v(N2)Ϊ0.17 mol��L-1��h-1
B.���¶���,�÷�Ӧ��ƽ�ⳣ��Ϊ0.037
C.��Ӧ���е�1 hʱ�ų�������Ϊ9.22 kJ
D.4 hʱ,���ټ���1 mol N2,�ﵽ�µĻ�ѧƽ��ʱ,N2��ת������ԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��4��ѧ��Ӧ�е������仯��ϰ���������棩 ���ͣ������
��֪ 0.4 mol Һ̬�º�����H2O2��Ӧ���ɵ�����ˮ����ʱ�ų�256.64 kJ��������
(1)д���º�H2O2��Ӧ���Ȼ�ѧ����ʽ: ��
(2)��֪H2O(l)=H2O(g) ��H=+44 kJ/mol,��16 gҺ̬��������˫��ˮ��Ӧ���ɵ�����Һ̬ˮʱ,�ų��������� ��
(3)������ӦӦ���ڻ���ƽ���,���ͷų����������Ϳ��ٲ�������������,����һ����ͻ�����ŵ��� ��
(4)�����������Һ��ͨ��һ�����ʵ����İ�����������,д����Ӧ�����ӷ���ʽ: ,�÷�Ӧ�Ļ�ԭ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��1���ʵ�������ʷ���ͻ�ѧ������ϰ���������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A.���ۡ���ά�صȸ߷��ӻ���������ڴ�����
B.�ǽ��������ﶼ������������
C.ʳ�ס����ʳ�ηֱ������ᡢ���
D.�����ЧӦ������������Һ�뽺��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com