
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________(填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________。
【答案】 Fe 离子键和共价键 2NaHCO3![]() Na2CO3+CO2↑+H2O 58%
Na2CO3+CO2↑+H2O 58%
【解析】(1)Fe2O3是主氧化剂,与Na发生置换反应,Fe元素发生还原反应,则还原产物为Fe;
(2)KClO4由钾离子与高氯酸根离子构成,高氯酸根离子中Cl原子与O原子之间形成共价键,含有离子键、共价键;
(3)碳酸氢钠分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4)碱石灰可以吸收二氧化碳、水蒸汽,剩余的气体为氮气,氮气的物质的量=![]() =0.75mol,根据氮元素守恒n(NaN3)=
=0.75mol,根据氮元素守恒n(NaN3)=![]() =0.5mol,
=0.5mol,
则m(NaN3)=0.5mol×65g/mol=32.5g,故NaN3的质量分数为![]() ×100%=58%。
×100%=58%。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是

A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是_______________________;
Y与过量浓硝酸反应后溶液中含有的盐的化学式为__________。
(2)某溶液中含有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________(填字母)。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
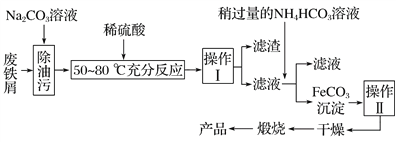
回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________________;
操作Ⅱ的方法为________________________________________________________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)_______________。
③请完成生成FeCO3沉淀的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一个反应表示二氧化硫被还原 ( )
A. SO2+2H2O+Cl2===H2SO4+2HCl B. SO2+2H2S===2H2O+3S
C. SO2+2NaOH===Na2SO3+H2O D. SO2+Na2CO3===Na2SO3+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是 ( )
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热
A. ②③ B. ①④ C. ①③ D. ②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。

请按要求回答下列问题:
(1) 写出②的元素名称____________;
(2) 将①、②和③三种元素相比较,非金属性最强的是____________(填元素符号);
(3) 元素⑥的氢化物的化学式为________________________;
(4) 元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)19.2g SO2在标准状况下的体积为______,其中含氧原子的物质的量为______,该气体在标准状况下的密度是______(若不能整除,保留两位小数)。
(2)0.5mol H3PO4质量是_______,含______个H3PO4分子,含______mol氧原子。
(3)在标准状况下,将体积为______ NH3溶于水得到0.5 mol·L-1的氨水500 mL;配制100 mL 0.1 mol·L-1CuSO4溶液,需要CuSO4·5H2O质量为________。
(4)现有M、N两种气态化合物,其摩尔质量之比为2:1,试回答下列问题:
①同温同压下,M、N气体的密度之比为____________;
②相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度相等,则两个容器中的压强之比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com