
分析 (1)元素周期表中,原子核外最外层电子数相等的元素位于同一主族;碘与氯是同主族元素;元素的非金属性越强,对应的氢化物越稳定,但氢化物的还原性越弱;
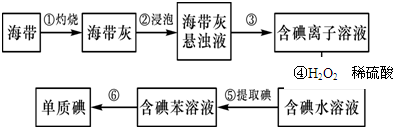
(2)将海带在坩埚中灼烧得到海带灰,将海带灰溶解、过滤得到滤液,滤液中含有碘离子,在酸性条件下,双氧水将碘离子氧化生成碘,然后用有机溶剂苯萃取碘,最后采用蒸馏方法得到有机溶剂和碘晶体.根据实验操作步骤①灼烧来分析用到的实验仪器;H2O2具有较强的氧化性,在酸性条件下可氧化碘离子;步骤⑤中应进行的操作为萃取、分液;
(3)IO3-+HSO3-→I2+SO42-+H++H2O反应中I元素的化合价从+5价降低到0价,S元素从+4价升高到+6价,根据得失电子守恒配平结合方程式解答.
解答 解:(1)氯原子结构图为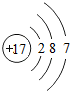 ,最外层7个电子,属于第ⅦA族元素,碘与氯是同族元素,所以它们位于元素周期表的第ⅦA族,同主族元素的非金属性越强,对应的氢化物越稳定,但氢化物的还原性越弱,F、Cl、Br、I属于同主族元素,所以HI的稳定性比HCl弱,HI的还原性比HCl强,
,最外层7个电子,属于第ⅦA族元素,碘与氯是同族元素,所以它们位于元素周期表的第ⅦA族,同主族元素的非金属性越强,对应的氢化物越稳定,但氢化物的还原性越弱,F、Cl、Br、I属于同主族元素,所以HI的稳定性比HCl弱,HI的还原性比HCl强,
故答案为:ⅦA;弱;强;
(2)灼烧固体物质一般使用坩埚,碘离子在酸性条件下可被H2O2氧化成单质碘,H2O2被还原为水,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O,第⑤步的操作是萃取、分液,用苯做萃取剂,分液后取上层,然后进行蒸馏获取碘单质,
故答案为:坩埚;2I-+H2O2+2H+=I2+2H2O;萃取、分液;
(3)IO3-+HSO3-→I2+SO42-+H++H2O反应中I元素的化合价从+5价降低到0价,得到5个电子,2个I原子得到10个电子,则S元素失去10个电子,依据得失电子守恒及原子个数守恒,方程式为:4NaIO3 +10NaHSO3 =7Na2SO4 +3H2SO4 +2I2+2H2O,离子方程式为:4IO3-+10HSO3-=2I2+10SO42-+6H++2H2O,2个I原子得到10个电子,制得1mol I2,转移10mol电子,即10NA,
故答案为:10NA.
点评 本题考查从海带中提取碘,涉及原子结构图书写、提取碘的实验操作、氧化还原的计算等,注意实验原理的理解应用,题目难度中等.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多 | |
| B. | 生石灰作食品干燥剂 | |
| C. | 打磨磁石制指南针 | |
| D. | 酸性重铬酸钾检验司机是否酒后驾车 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中铝、铁的物质的量之比1:2 | |
| B. | 混合物与稀硝酸反应后的溶液还能溶解1.28g Cu | |
| C. | 将0.28mol气体通人水中并完全被吸收时,需要消耗0.14mol氧气 | |
| D. | 10.7g固体为Al(OH)3和Fe(OH)3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁粉与氯气反应生成FeCl2 | |
| B. | 少量SO2通入Ca(ClO)2 溶液生成CaSO3沉淀 | |
| C. | 常温下,1 mol Fe与足量浓硝酸反应,转移2NA个电子 | |
| D. | 硅酸钠的水溶液是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
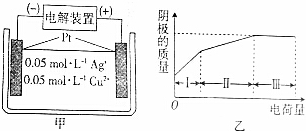
| A. | 区间Ⅰ,在阴极上有金属银析出 | |
| B. | 区间Ⅰ、Ⅱ、Ⅲ中溶液的pH均降低 | |
| C. | 区间Ⅱ,在阳极上有氧气放出 | |
| D. | 区间Ⅱ析出的固体质量是区间Ⅰ的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量 | |
| B. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| C. | 工业上用离子交换膜法电解饱和食盐水制烧碱 | |
| D. | 工业上采用电解(省电能30%)的AlCl3-KCl熔融体的方法制取金属铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com