12.
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO
2、NO
x等进行研究具有重要意义.请回答下列问题:
(1)有人设想,用硫SO
2-碘循环分解水制氢,主要涉及下列反应:
ⅠSO
2+2H
2O+I
2=H
2SO
4+2HI
Ⅱ2HI(g)?H
2(g)+I
2(g)
Ⅲ2H
2SO
4 (l )?2SO
2(g)+O
2(g)+2H
2O(g)
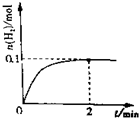
①一定温度下,向2L密闭容器中加入1molHI(g),发生反应Ⅱ,H
2物质的量随时间的变化如图所示.
0-2min内的平均反应速率v(HI)=0.05mol/(L•min),
相同温度下,若向2L密闭容器中开始加入的HI(g)物质的量是原来的2倍,则AB是原来的2倍.(填字母编号)
A.平衡时I
2的物质的量 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时H
2的体积分数
②反应Ⅲ平衡常数表达式为K=c
2(SO
2).c(O
2).c
2(H
2O),能说明该反应恒容下达到平衡的标志是BC(填字母)
A. 2v正(SO
2)=v逆(O
2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氧气的体积分数不变
③在CuCl
2热溶液中通入SO
2气体可制备CuCl沉淀,写出该反应的离子方程式2Cu
2++2Cl
-+SO
2+2H
2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H
++SO
42-(2)为减少CO、SO
2污染的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H
2(g)+$\frac{1}{2}$O
2═H
2O(g)△H=-241.8kJ•mol
-1C(s)+$\frac{1}{2}$O
2═CO(g)△H=-110.5kJ•mol
-1写出焦炭与水蒸气反应的热化学方程式:C(s)+H
2O(g)═CO(g)+H
2(g);△H=+131.3kJ/mol.
②在含硫燃料中加入石灰石,燃煤生成的SO
2即可转化为CaSO
4.化学方程式为2SO
2+2CaCO
3+O
2$\frac{\underline{\;高温\;}}{\;}$2CaSO
4+2CO
2.
(3)汽车尾气中NO
x和CO的生成及转化
①燃油不完全燃烧时产生CO,有人设想按下列反应除去:2CO(g)=2C(s)+O
2(g)
已知该反应的△H>0,简述该设想不能实现的依据:该反应是焓增熵减的反应,所以在任何温度下都不自发.
②已知汽缸中生成NO的反应为:N
2(g)+O
2(g)?2NO(g)△H>0
若1mol空气含0.8molN
2和0.2molO
2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10
-4mol.计算该温度下的平衡常数K=4×10
-6.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO
2+N
2.

 阅读快车系列答案
阅读快车系列答案
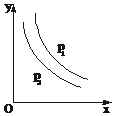 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( ) .
. 空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题: