

分析 Ⅰ.根据盖斯定律书写目标热化学方程式;
Ⅱ.用稀硫酸和浓硝酸的混合液在加热条件下溶解含Cu、Al、Fe及少量Au、Pt等金属的混合物,过滤除去不溶的Au、Pt,得滤液1,向滤液1中加入双氧水氧化溶液里的Fe2+,然后滴加NaOH溶液调节溶液pH,促进Fe3+、Al3+水解完全生成Fe(OH)3、Al(OH)3,并过滤得到滤渣2和滤液2,滤液2经蒸发冷却、结晶、过滤得到胆矾晶体,滤液2用稀硫酸溶解后用Al置换Fe3+生成Fe,并过滤得滤液,同样蒸发冷却、结晶、过滤得到硫酸铝晶体;
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生了反应,所以滤渣1的成分是Pt和Au;
(2)根据双氧水具有氧化性且被还原为水,产物无杂质无污染进行分析;
(3)滤渣2为氢氧化铁和氢氧化铝的混合物,加入酸溶液后生成了铁离子、铝离子,向该溶液中加入铝粉,铁离子与铝反应生成铁和铝离子,据此写出反应的离子方程式;
(4)加热硫酸铜晶体时需要放在坩埚中进行;
(5)放电时,Zn为负极,失去电子,发生电极反应:Zn-2e-+2OH-=Zn(OH)2;
根据K2FeO4中铁的化合价由+6变化为+3,化合价降低3;
正反应中Fe元素的化合价降低,K2FeO4为正极,则充电时为阳极,发生氧化反应:2Fe(OH)3+10OH--6e-=2FeO42-+8H2O.
解答 解:Ⅰ.已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,②+③-①×2得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1;
Ⅱ.用稀硫酸和浓硝酸的混合液在加热条件下溶解含Cu、Al、Fe及少量Au、Pt等金属的混合物,过滤除去不溶的Au、Pt,得滤液1,向滤液1中加入双氧水氧化溶液里的Fe2+,然后滴加NaOH溶液调节溶液pH,促进Fe3+、Al3+水解完全生成Fe(OH)3、Al(OH)3,并过滤得到滤渣2和滤液2,滤液2经蒸发冷却、结晶、过滤得到胆矾晶体,滤液2用稀硫酸溶解后用Al置换Fe3+生成Fe,并过滤得滤液,同样蒸发冷却、结晶、过滤得到硫酸铝晶体;
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,Au、Pt和酸不反应,所以滤渣是Au、Pt,
故答案为:Au、Pt;
(2)第②步加入试剂X的作用是将Fe2+氧化为Fe3+,双氧水与亚铁离子的反应为:2Fe2++H2O2+2H+=2Fe3++2H2O,双氧水做氧化剂被还原后为水,不引入杂质,对环境无污染,而高锰酸钾溶液、漂白粉、氯气做氧化剂,反应后引进了装置,且污染环境,所以试剂X最好选用双氧水,
故答案为:d;
(3)根据实验流程,酸浸液中含有铁离子和铝离子,向酸浸液中加入铝粉后,铁离子与铝发生反应生成铁和铝离子,反应的离子方程式为Fe3++Al=Al3++Fe,
故答案为:Fe3++Al=Al3++Fe;
(4)由CuSO4•5H2O制备CuSO4时,应把CuSO4•5H2O放在坩埚中,
故答案为:坩埚;
(5)放电时,Zn为负极,失去电子,发生电极反应:Zn-2e-+2OH-=Zn(OH)2;
K2FeO4中铁的化合价由+6变化为+3,化合价降低3,所以每有1molK2FeO4被还原,转移电子的物质的量为3mol,
正反应中Fe元素的化合价降低,K2FeO4为正极,则充电时为阳极,发生氧化反应:Fe(OH)3+5OH--3e-=FeO42-+4H2O;
故答案为:Zn-2e-+2OH-=Zn(OH)2;3mol;Fe(OH)3+5OH--3e-=FeO42-+4H2O.
点评 本题考查较为全面,涉及热化学方程式书写、混合物的分离、可充电电池等知识,综合性较强,其中电化学是难点,注意正负极和阴阳极电极反应式的书写.


科目:高中化学 来源: 题型:多选题
| A. | 金属阳离子的半径大于它的原子半径 | |
| B. | 金属阳离子的半径小于它的原子半径 | |
| C. | 非金属阴离子的半径小于其原子半径 | |
| D. | 核外电子排布相同的不同微粒,核电荷数越大半径越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高氯酸(HClO4)的酸性比硫酸强 | B. | 次氯酸的氧化性比稀硫酸强 | ||
| C. | 氯化氢比硫化氢的热稳定性好 | D. | 硫离子还原性比氯离子还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物主要来自自然界众多的有机体 | |
| B. | 可以人工合成 | |
| C. | 有机物分子中的碳原子成键方式具有多样性 | |
| D. | 可以由无机物进行转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应.据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应.据图回答下列问题: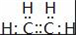 ,D中官能团的名称是羟基.
,D中官能团的名称是羟基.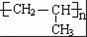 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物里,只存在离子键,没有共价键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 由多种元素组成的多原子分子里,一定只存在极性键 | |
| D. | 在共价化合物分子内,一定不存在离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com