
| A. | 1<n<2 | B. | 1<n<5 | C. | 2<n<4 | D. | 2<n<5 |
分析 调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol,且需要化学反应向着正反应方向进行,正反应方向是气体物质的量减小的方向,所以需要3+x>5,再根据可逆反应中,反应物不能完全转化来确定x的其他范围.
解答 解:调节反应器的温度,使反应达到平衡时保持容器中气体总物质的量为5mol,且需要化学反应向着正反应方向进行,正反应方向是气体物质的量减小的方向,所以需要3+x>5,即x>2,设化学反应发生后,消耗的A的物质的量是n,则
A(g)+4B(g)?2C(g)+D(g)
初始量:1 x 1 1
变化量:n 4n 2n n
末态量:1-n x-4n 1+2n 1+n
所以1-n+x-4+1+2n+1+n=5,x=2+2n
根据可逆反应中,反应物不能完全转化,所,0<n<1,代入x=2+2n得到x<4,综上可以知道,x的范围是2<x<4,
故选C.
点评 本题考查学生化学反应的建立等方面的知识,注意知识的归纳和整理是解题的关键,注意化学平衡的移动极限情况与物质的量的取值范围的分析判断,难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4NO3→N2+O2+H2O | B. | NH4NO3→NH3+HNO3 | ||
| C. | NH4NO3→O2+HNO3+H2O | D. | NH4NO3→N2+HNO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 3:2 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可通过热还原法制备金属铝和铁 | |
| B. | 工业制硫酸产生的废气需用石灰水吸收 | |
| C. | 淀粉、植物油、蛋白酶均为高分子化合物 | |
| D. | 水晶、玛瑙、光导纤维、陶瓷的主要成分都是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0-10min的平均反应速率:n(ClNO)=7.5×10-3mol•L-1•min-1 | |
| B. | 平衡时NO的转化率为75% | |
| C. | 其它条件保持不变,反应若在恒压条件下进行,平衡时NO的转化率变大 | |
| D. | 升高温度,反应的平衡常数减小,则△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.10 mol•L-1 H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5该溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH为8.5的上述体系中通入极少量Cl2的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
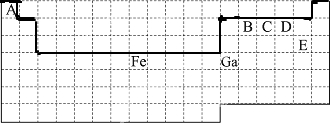 .
.
 、
、 (写2种).
(写2种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
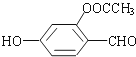 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )| A. | 2.5mol | B. | 3mol | C. | 3.5 mol | D. | 4 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com