
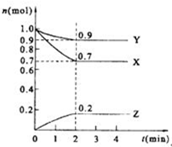
 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=$\frac{△c}{△t}$计算反应速率v(Z);
(3)混合气体的平均相对分子质量M=$\frac{m}{n}$,混合气体密度ρ=$\frac{m}{V}$来判断;
(4)根据化学反应中的三行式进行计算;
(5)根据影响化学反应速率的因素分析,升温、增压等均能加快反应速率;
(6)A.反应伴随能量变化,升高温度改变化学反应的限度;
B.升高温度正逆反应速率均加快;
C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关;
D.化学反应的限度与反应物性质和外部因素有关,是可能改变的;
E.增大Y的浓度,正反应速率加快,逆反应速率同时加快.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)在2min时间内,用Z表示反应的平均速率v(Z)=$\frac{△c(Z)}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(3)混合气体的平均相对分子质量M=$\frac{m}{n}$,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,混合气体密度ρ=$\frac{m}{V}$,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,故答案为:增大;不变;
(4)3X+Y?2Z(设Y的变化量是x)
初始量:a b 0
变化量:3x x 2x
平衡量:a-3x b-x 2x
当n (X)=n (Y)=n (Z)时,a-3x=b-x=2x,则a=5x,b=3x,所以原混合气体中a:b=5:3,
故答案为:5:3;
(5)A.恒压时充入He,体系分压减小,反应速率减小,故错误;
B.恒容时充入He,不影响体系压强和浓度,反应速率不变,故错误;
C.恒容时充入X,X的浓度增大,反应速率加快,故正确;
D.及时分离出Z,浓度不增加,压强减小,平衡右移,反应速率不加快,故错误;
E.升高温度,任何化学反应速率加快,故正确;
F.选择高效的催化剂,反应速率加快,故正确,
故答案为:CEF;
(6)A.反应伴随能量变化,升高温度改变化学反应的限度,故正确;
B.升高温度正逆反应速率均加快,故错误;
C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关,故正确;
D.化学反应的限度与反应物性质和外部因素有关,是可能改变的,故错误;
E.增大Y的浓度,正反应速率加快,逆反应速率同时加快,故错误,
故答案为:AC.
点评 本题涉及化学平衡的建立、化学平衡状态的判断以及有关化学反应速率和三行式的计算知识,属于综合知识的考查,难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:实验题
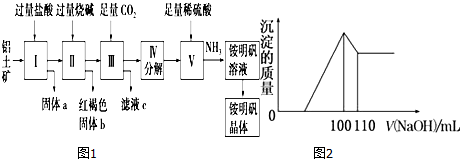
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为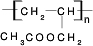 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
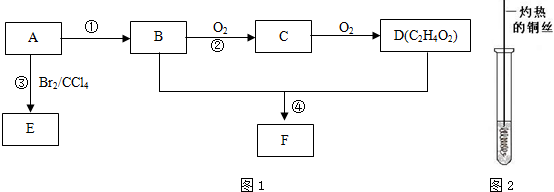
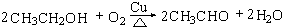 .
.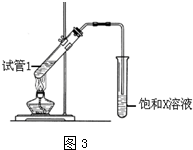 (4)D与碳酸氢钠溶液反应的离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑.
(4)D与碳酸氢钠溶液反应的离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
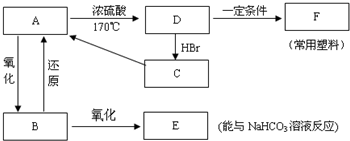
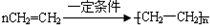 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com