
 从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质.
从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质. .
. 分析 (1)A.同周期自左而右电负性增大;
B.单键中含有1个σ键,双键中含有1个σ键和1个π键;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8;
D.镁的3s轨道是全充满,能量低比较稳定,第一电离能高于同周期相邻元素;
(2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构;
光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是 ,分子中C原子采取sp2杂化成键;
,分子中C原子采取sp2杂化成键;
(3)根据Cu的电子排布式书写Cu2+离子的电子排布式,注意原子形成离子先失去高能层中高能级电子;
根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键.
解答 解:(1)A.同周期自左而右电负性增大,故电负性O>N>C,故A正确;
B.乙烯的结构式为 ,分子中含有一个双键和4个单键,所以乙烯分子中含有一个双键和4个单键,则含有5个σ键和1个π键,故B错误;
,分子中含有一个双键和4个单键,所以乙烯分子中含有一个双键和4个单键,则含有5个σ键和1个π键,故B错误;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,故D错误;
D.镁的3s能级有2个电子,轨道是全充满,能量低比较稳定,Na、Mg、Al属于同一周期元素且原子序数依次增大,其第一电离能随着原子序数的增大而增大,但第ⅡA元素的第一电离能大于第ⅢA族的,故第一电离能Mg>Al>Na,故D错误;
故选:A;
(2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构,故羰基硫(OCS)结构式为O=C=S,
光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是 ,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,
,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,
故答案为:O=C=S;平面三角形;
(3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9,
SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为 ,
,
故答案为:1s22s22p63s23p63d9;sp3; .
.
点评 本题综合性较大,涉及电离能、电负性、晶胞结构、等电子体、杂化轨道、配位键、核外电子排布规律等,难度中等,注意等电子体中价层电子数相同的微粒具有相似的结构.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有C-H键的数目为3NA | |
| B. | 常温下,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 标准状况下22.4LSO3中含有的氧原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的简单离子还原性大于D | |
| B. | D元素只能以化合态存在于自然界中 | |
| C. | A元素所形成离子的半径有可能大于He原子的半径 | |
| D. | B、D的原子不能相互结合形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
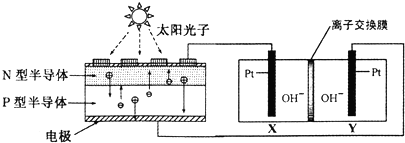
| A. | 图中N型半导体为正极,P型半导体为负极 | |
| B. | 图中离子交换膜为阳离子交换膜 | |
| C. | 反应完毕,该装置中电解质溶液的碱性增强 | |
| D. | 人体呼出的气体参与X电极的反应:CO2+2e一+H2O═CO+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
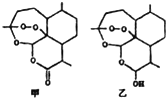 2015年我国药学家屠呦呦因创制青蒿素与双氢青蒿素用于治疗疟疾获得诺贝尔科学奖.图甲为青蒿素分子的结构简式,乙为双氢青蒿素分子的结构简式,其活性结构为分子中的“-O-O-”.下列说法错误的是( )
2015年我国药学家屠呦呦因创制青蒿素与双氢青蒿素用于治疗疟疾获得诺贝尔科学奖.图甲为青蒿素分子的结构简式,乙为双氢青蒿素分子的结构简式,其活性结构为分子中的“-O-O-”.下列说法错误的是( )| A. | 甲分子式为C15H22O5 | |
| B. | 甲、乙分子中均只存在2个六元环 | |
| C. | 甲转化成乙后水溶性增强 | |
| D. | 甲、乙分子中的活性结构“-O-O-”具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2、18O3互为同位素 | |
| B. | 次氯酸的电子式为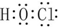 | |
| C. | 氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价 | |
| D. | 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com