
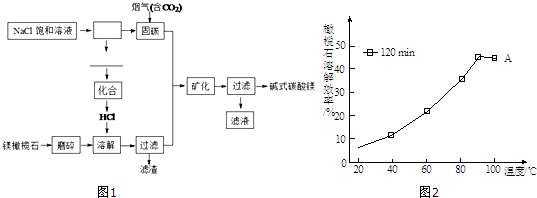
分析 (1)工业上用氯电解饱和食盐水会获得烧碱,氢氧化钠溶液可以吸收二氧化碳固碳,生成氢气和氯气可以制备盐酸;
(2)根据能和二氧化碳之间反应的物质能来固定二氧化碳来回答;
(3)温度对化学反应平衡移动的影响知识来回答,20min后,溶解达到平衡,而该反应是放热,升温,平衡逆向移动;
(4)所得碱式碳酸镁沉淀中含有少量NaCl.为提纯沉淀可采取的方法是利用氯化钠易溶分析,可循环利用的物质是流程中参加反应,最后又重新生成的物质;
(5)硅酸盐是构成地壳岩石的主要成分,化学上常用二氧化硅和氧化物的形式表示其组成,例如:镁橄榄石(Mg2SiO4)常以2MgO•SiO2表示,可看出改写中要保证原子总数,化合价不变,按化合价分别写出氧化物的化学式,如有多个原子,在前面加上系数,使之成为倍数,据此进行分析解答.
解答 解:(1)根据流程图,固碳时主要反应的方程式为NaOH(aq)+CO2 (g)=NaHCO3 (aq),工业上用氯电解饱和食盐水会获得烧碱,缺少烧碱的制取流程,生成的氯化氢是电解氯化钠溶液生成的氢气和氯气反应得到,故答案为:电解;H2、Cl2;
(2)所给的物质中,NH3•H2O、Na2CO3 可以和二氧化碳发生生成碳酸氢铵、碳酸氢钠,能用作“固碳”的试剂,故答案为:BC;
(3)图中所示数据以及曲线变化知道,20min后,溶解达到平衡,而该反应是放热,升温,平衡逆向移动,则溶解效率降低,
故答案为:120min后,溶解达到平衡,而反应放热,升温平衡逆向移动,溶解效率降低;
(4)所得碱式碳酸镁沉淀中含有少量NaCl,氯化钠溶于水,为提纯可采取洗涤的方法除去,流程分析可知NaCl在反应中参加反应,最后重新生成,可以循环使用,
故答案为:洗涤;NaCl;
(5)根据硅酸盐写成氧化物的规律,Mg9FeSi5O20用氧化物的形式可表示为9MgO•FeO•5SiO2,故答案为:9MgO•FeO•5SiO2.
点评 本题是一道化学和生产结合的工艺流程题,是现在考试的热点,注意知识的迁移和灵活应用是解题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
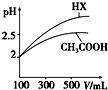 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1:V2的值 | B. | V1和V2的值 | ||
| C. | X和Y的物质的量 | D. | 盐酸和稀硫酸的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2发生氧化反应 | |
| B. | NH4Cl 中的氮元素被还原 | |
| C. | N2既是氧化产物,又是还原产物 | |
| D. | 每生成1mol N2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-1-丁烯 | B. | 2,3-二甲基-2-乙基丁烷 | ||
| C. | 3,3,5,5-四甲基己烷 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BOH的电离方程式是BOH═B++OH- | |
| B. | 将一定体积的上述两种溶液混合后得到中性溶液,则V(HA)<V(BOH) | |
| C. | 在0.1 mol•L-1BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+) | |
| D. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1,则溶液的pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com