
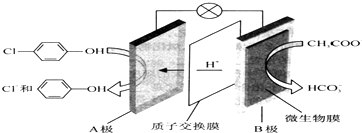
| A. | B为电池的正极,发生还原反应 | |
| B. | A极的电极反应式为: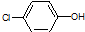 +e-=Cl-+ +e-=Cl-+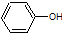 | |
| C. | 电流方向为从B极沿导线经小灯泡流向A极 | |
| D. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+个数为0.2NA |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极,以此解答该题.
-OH+Cl-,电流从正极经导线流向负极,以此解答该题.
解答 解:原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,电流从正极经导线流向负极,
-OH+Cl-,电流从正极经导线流向负极,
A.A为正极,发生还原反应,B为负极发生氧化反应,故A错误;
B.BA为正极,正极有氢离子参与反应,电极反应式为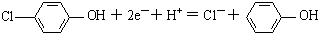 ,故B错误;
,故B错误;
C.电流从正极A沿导线流向负极B,故C错误;
D.据电荷守恒,当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA,故D正确;
故选:D.
点评 本题涉及原电池的工作原理以及应用的考查,注意把握原电池中电极的判断和电极方程式的书写方法,侧重于学生的分析能力的考查,注意知识的迁移和应用是解题的关键,难度中等.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
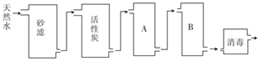
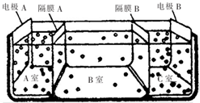
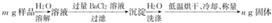
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 装置 图 | 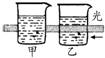 |  | 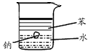 | 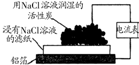 |
| 主要 现象 | 乙装置中有光亮通路,甲装置无明显现象 | 两试管中都有气泡产生,但乙比甲速率快 | 钠在水与苯层之间上下跳动,且有气泡产生 | 电流表指针发生偏转 |
| 实验 结论 | 乙装置中分散系为胶体,甲装置中分散系不是胶体 | 可验证FeCl3对H2O2分解反应有催化作用 | 证明密度ρ(苯)<ρ(钠)<ρ(水) | 电子从铝箔流出,经电流表、流到活性炭 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷、新戊烷、异戊烷互为同分异构体 | |
| B. | 扁桃酸( )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 | |
| C. |  互为同系物 互为同系物 | |
| D. | 四氯乙烯分子中所有原子都处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 验证淀粉已水解 | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的银氨溶液并水浴加热 |
| B | 比较醋酸和次氯酸的酸性强弱 | 用PH试纸测定0.1mol•L-1醋酸钠溶液和0.01mol•L-1次氯酸钠溶液的PH |
| C | 证明Cl2的氧化性比Br2氧化性强 | 0.1mol•L-1 NaBr溶液中加入适量的新制氯水,反应后再加入适量的四氯化碳,振荡,观察下层液体的颜色 |
| D | 除去苯中混有的少量苯酚 | 向其中加入适量的溴水再过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com