
分析 (1)浓H2SO4的物质的量浓度c=$\frac{1000ρω}{M}$,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(3)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)该浓H2SO4的物质的量浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xL,所以xL×18.4mol/L=0.5L×0.5mol/L,
解得:x≈0.013.6L=13.6mL,所以应量取的浓硫酸体积是13.6mL,
故答案为:13.6mL;
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、20mL量筒、500mL容量瓶,还缺少胶头滴管和500mL容量瓶,
故答案为:20;胶头滴管、500mL容量瓶;
(3)①浓硫酸溶解后未冷至室温即进行转移、定容,一旦冷却下来会导致体积偏小,导致配制的溶液体积偏小,配制的溶液浓度偏高,
故答案为:偏高;
②定容时俯视刻度线,导致配制的溶液体积偏小,溶液浓度偏高,
故答案为:偏高;
③所用过的烧杯、玻璃棒未洗涤,配制的溶液中溶质的物质的量偏小,溶液浓度偏低,
故答案为:偏低.
点评 本题考查了一定物质的量浓度溶液的配制的误差分析,题目难度中等,注意从c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断,明确配制一定物质的量浓度的溶液的方法为解答关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA | |
| C. | 常温常压下,18g水含有的分子数为 NA | |
| D. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 滤纸的 颜色 变化 | 玻璃片(Ⅰ) 上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
| 玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
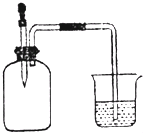
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测得新制氯水的pH为5 | |
| B. | 向某种消毒液(NaClO)中滴加盐酸,能抑制NaClO水解,降低漂白效果 | |
| C. | 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用 | |
| D. | 为便于储存,需要将氯气液化[Cl2(g)?Cl2(l)],可以采取加压或者升温的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
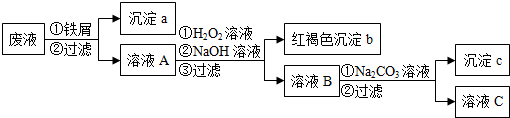
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
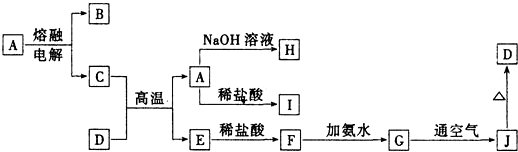
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com