
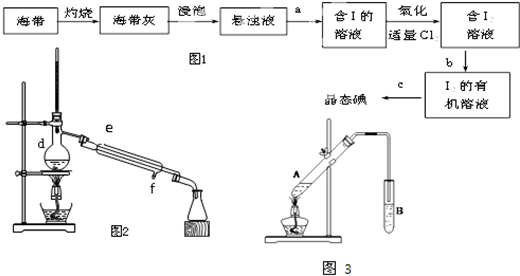
分析 (1)海带灼烧后溶解,以离子形式存在,a为过滤,得到含碘离子的溶液,再加氯气为氧化剂,可氧化碘离子生成碘单质,b为萃取,得到碘的有机溶液,c为蒸馏,
①萃取剂的选取标准为:萃取剂和原溶剂不互溶、萃取剂和溶质不反应、溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度;
②该仪器是蒸馏烧瓶;冷却水下进上出,在冷凝管中停留时间上,效果好;
(2)①为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸,最后加入乙酸;
②饱和碳酸钠溶液能吸收乙醇、能和乙酸反应,能降低乙酸乙酯的溶解度.
解答 解:(1)①萃取剂的选取标准为:萃取剂和原溶剂不互溶、萃取剂和溶质不反应、溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度,四氯化碳和苯都符合萃取剂标准,乙醇易和水互溶,所以能作萃取剂的为BC,故选BC;
②仪器d的名称是蒸馏烧瓶,冷凝管中的水流方向是由f至e,故答案为:蒸馏烧瓶;由f至e;
(2)①为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸,乙酸价格昂贵且易挥发,为提高醋酸的利用率,所以最后加入醋酸,故选C;
②乙醇极易溶于水,乙酸能和碳酸钠反应生成可溶性的醋酸钠、二氧化碳和水,乙酸乙酯在饱和碳酸钠溶液中的溶解度小于在水溶液中的溶解度,所以B中试剂为饱和碳酸钠溶液,与乙酸乙酯分层后分液需要的仪器为分液漏斗,故答案为:饱和碳酸钠溶液;分液漏斗.
点评 本题考查物质的分离提纯,为高频考点,把握物质的性质、混合物分离方法、乙酸乙酯制备实验等为解答的关键,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 正极附近的S042-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 铜片上有H2逸出 | |
| D. | 溶液的pH逐渐变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸见光或受热易分解,必须保存在棕色瓶中 | |
| B. | 浓HNO3是种强氧化剂,但只能使湿润蓝色的石蕊试纸显红色而不褪色 | |
| C. | 稀HNO3和活泼金属反应时主要得到氢气 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 丙烷(C3H8)有两种同分异构体 | |
| C. | 乙烯和苯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移的电子的物质的量为10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com