
| X | |||
| Z |
| A. | 离子半径:r(Y)>r(Z)>r(W) | |
| B. | Z的简单离子能破坏水的电离平衡 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z的简单气态氢化物的热稳定性比W的强 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,根据元素在周期表中的位置知,X位于第二周期,Z位于第三周期,X的最低负价绝对值与其原子最外层电子数相等,原子最外层电子数为4,则X是C元素,可推知Z是S元素,W原子序数大于S,所以W是Cl元素,X、Y、Z原子序数之和是W的2倍,Y的原子序数为17×2-6-16=12,则Y是Mg元素,据此解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,根据元素在周期表中的位置知,X位于第二周期,Z位于第三周期,X的最低负价绝对值与其原子最外层电子数相等,原子最外层电子数为4,则X是C元素,可推知Z是S元素,W原子序数大于S,所以W是Cl元素,X、Y、Z原子序数之和是W的2倍,Y的原子序数为17×2-6-16=12,则Y是Mg元素.
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(S2-)>r(Cl-)>r(Mg2+),故A错误;
B.溶液中S2-发生水解,促进水的电离平衡,故B正确;
C.CS2含有共价键,MgCl2含有离子键,二者化学键类型不相同,故C错误;
D.氢化物的稳定性与元素非金属性一致,W(Cl)的非金属性大于Z(S),所以元素Z的简单气态氢化物的热稳定性比W的简单气态氢化物弱,故D错误;
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握元素周期表的结构,注意掌握微粒半径比较规律.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ③④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该溶液中:Na+、SO42-、CH2O、Mg2+可以大量共存 | |
| B. | 该溶液中Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 与NaHCO3溶液混合:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑ | |
| D. | 每腐蚀32gCu需要1mol/L该溶液500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI溶液中:Ca2+、Na+、ClO-、Cl- | |
| B. | 滴入酚酞试液显红色的溶液中:Al3+、K+、AlO2-、SO42- | |
| C. | c(H+)=10-12mol•L-1的溶液中:K+、Na+、NO3-、Cl- | |
| D. | 加入铝粉产生氢气的溶液中:Na+、Mg2+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通往入溶有少量氨的BaCl2溶液中,无白色沉淀生成 | |
| B. | 常温下,稀释0.1mol/L的醋酸,溶液中所有离子浓度均下降 | |
| C. | 等体积等浓度的CH3COOH与NaOH溶液混合后,溶液中离子浓度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
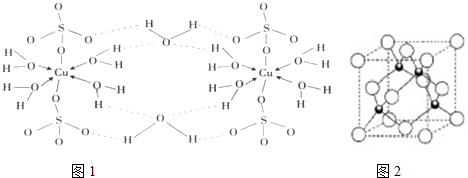
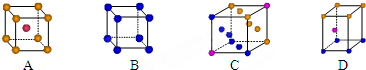
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | 12Mg与水反应缓慢,20Ca与水反应较快 | 56Ba(IIA族)与水反应更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | Ⅳ族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 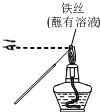 用装置甲检验溶液中是否有K+ | B. | 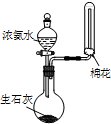 用装置乙制取并收集少量NH3 | ||
| C. | 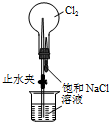 用装置丙进行喷泉实验 | D. |  用装置丁加热熔融NaOH固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com