
分析 根据二者性质的异同判断,碳酸氢钠不稳定,加热易分解,与盐酸反应时,碳酸氢钠反应较剧烈,加入氯化钙,只有碳酸钠反应生成沉淀,二者水溶液pH不同,以此解答.
解答 解:①碳酸氢钠受热易分解,而碳酸钠不能,则加热,观察是否有气体放出可鉴别,反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
②碳酸氢钠与盐酸反应快,加盐酸时的反应现象不同,可鉴别,试剂为HCl,发生的反应为NaHCO3+HCl=NaCl+H2O+CO2↑、Na2CO3+2HCl=NaCl+H2O+CO2↑,
故答案为:HCl;NaHCO3+HCl=NaCl+H2O+CO2↑、Na2CO3+2HCl=NaCl+H2O+CO2↑;
③碳酸钠与氯化钙反应,而碳酸氢钠与氯化钙不反应,反应现象不同,可鉴别,试剂为CaCl2,发生反应为CaCl2+Na2CO3=CaCO3↓+2NaCl,
故答案为:CaCl2;CaCl2+Na2CO3=CaCO3↓+2NaCl;
④配制等浓度的二者的溶液,测定pH,pH大的为Na2CO3,故答案为:测等浓度溶液的pH.
点评 本题以碳酸钠和碳酸氢钠为载体考查物质的鉴别,为高频考点,把握物质的性质差异为解答的关键,注意利用不同现象鉴别物质,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 有剧毒 | B. | 有腐蚀性 | C. | 不支持燃烧 | D. | 不能供给呼吸 |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:实验题
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为__ 。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是 。
(3)丙组同学取10mL 0.1mol/L KI溶液,加入6mL 0.1mol/L FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有 (填离子符号) ,由此可以证明该氧化还原反应为 反应(填“可逆”或“不可逆”)。
,由此可以证明该氧化还原反应为 反应(填“可逆”或“不可逆”)。
(4)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 ;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 ;生成沉淀的原因是 (用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙、丙是三种单质,其中甲是固体;乙、丙是气体;A、B、C、D、E都是化合物,很多建筑物因含有E而受到酸雨的侵蚀.上述物质的相互转化关系如图所示(部分产物已略去):
甲、乙、丙是三种单质,其中甲是固体;乙、丙是气体;A、B、C、D、E都是化合物,很多建筑物因含有E而受到酸雨的侵蚀.上述物质的相互转化关系如图所示(部分产物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
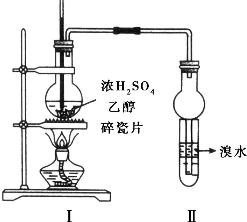 实验室制取乙烯的装置如图所示,试回答:
实验室制取乙烯的装置如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
卤素互化物(XX’n)的性质与卤素单质相似,其中非金属性: X<X’。已知反应如下:3H2O + 2ICl3 = 5HCl + ICl + HIO3。则下列判断正确的是:( )
A.XX’n 属于活泼非金属单质
B.ICl3 属于共价化合物
C.上述反应中HCl是还原产物
D.ICl溶于水的反应:ICl + H2 O = HIO + HCl 不属于氧化还原反应
O = HIO + HCl 不属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com