
| A. | v(D)=0.4 mol/( L•S ) | B. | v(C)=30 mol/( L•min ) | ||
| C. | v(B)=36 mol/( L•min ) | D. | v(A)=0.15 mol/( L•S ) |
分析 根据反应速率之比等于化学计量数之比,可将各种物质转化成A,以此可比较反应速率大小,注意单位换算成统一的速率单位比较.
解答 解:A.v(D)=0.4 mol/( L•S ),则v(A)=$\frac{1}{2}$v(D)=0.2 mol/( L•S );
B.v(C)=30 mol/( L•min ),则v(A)=$\frac{1}{2}$v(C)=15 mol/( L•min )=0.2 5mol/( L•S );
C.v(B)=36 mol/( L•min ),则v(A)=$\frac{1}{3}$v(C)=12 mol/( L•min )=0.2mol/( L•S );
D.v(A)=0.15 mol/( L•S ).
则反应速率最大的为B,
故选B.
点评 本题考查化学反应速率快慢比较,为高频考点,侧重于学生的分析、计算能力的考查,注意转化为同一物质表示的速率进行比较,比较大小时要注意单位是否相同,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 .
.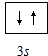
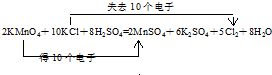
 ,氯原子核外有17不同运动状态的电子.
,氯原子核外有17不同运动状态的电子.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
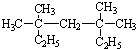 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷; ,B
,B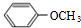 ,C
,C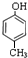 .
.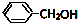 四种有机物能氧化成醛的是AD; 能消去成烯的是BC;
四种有机物能氧化成醛的是AD; 能消去成烯的是BC; 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃在适当条件下都能发生水解反应 | |
| B. | 所有卤代烃都是通过取代反应制得的 | |
| C. | 所有卤代烃在适当条件下都能发生消去反应 | |
| D. | 所有卤代烃都是难溶于水且密度比水小的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 | |
| B. | s能级原子轨道呈球形,处于该轨道上的电子只能在球壳内运动 | |
| C. | p能级原子轨道呈哑铃状,随着能层的增加,p能级原子轨道也在增多 | |
| D. | p能级原子轨道与s能级原子轨道的平均半径都随能层序数的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
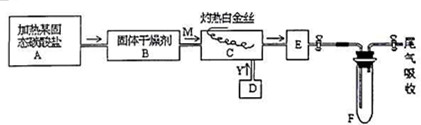
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
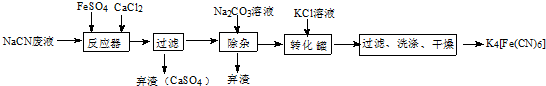
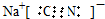 ;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

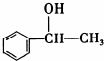 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ①②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com