
| A. | 它的组成可以用H3+表示 | B. | 它比普通氢分子多一个氢原子核 | ||
| C. | 它一定含3个中子 | D. | 可以推测它的化学性质与H2不同 |
科目:高中化学 来源: 题型:实验题
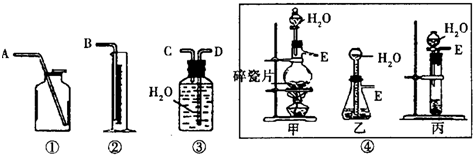
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
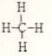 ;X、Z、N形成的原子个数比1:1:1的分子的电子式
;X、Z、N形成的原子个数比1:1:1的分子的电子式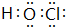 .
.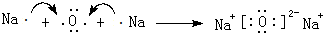 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
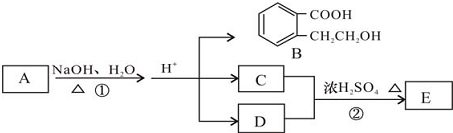
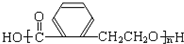 .
.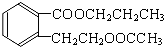 +2 NaOH$\stackrel{△}{→}$
+2 NaOH$\stackrel{△}{→}$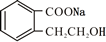 +CH3COONa+CH3CH2CH2OH.
+CH3COONa+CH3CH2CH2OH.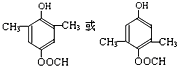 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
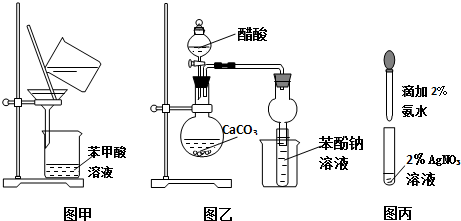
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
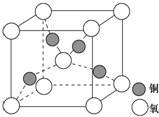 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量前先调节托盘天平的零点 | |
| B. | 称量时左盘放被称量物,右盘放砝码 | |
| C. | 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| D. | 用托盘天平可以准确称量至0.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com